11.9:
Ecuación de Clausius-Clapeyron
11.9:
Ecuación de Clausius-Clapeyron
El equilibrio entre un líquido y su vapor depende de la temperatura del sistema; un aumento de la temperatura provoca un aumento correspondiente de la presión de vapor de su líquido. La ecuación de Clausius-Clapeyron proporciona la relación cuantitativa entre la presión de vapor de una sustancia (P) y su temperatura (T); predice la velocidad a la que aumenta la presión de vapor por unidad de aumento de temperatura.
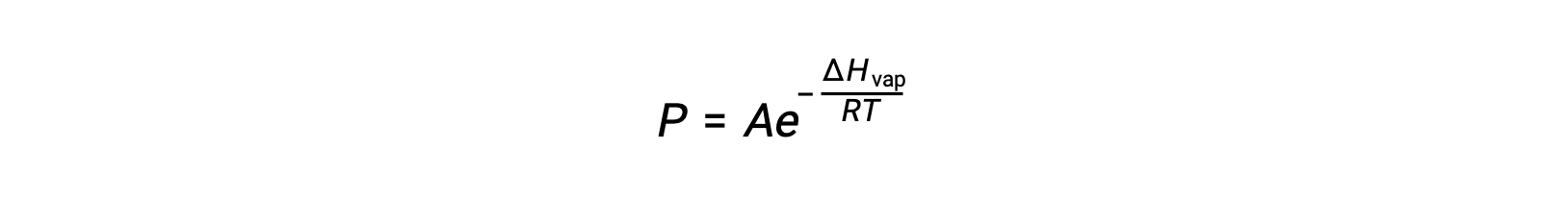
Donde ΔHvap es la entalpía de la vaporización del líquido, R es la constante de gas, y A es una constante cuyo valor depende de la identidad química de la sustancia. La temperatura (T) debe estar en kelvin en esta ecuación. Sin embargo, dado que la relación entre la presión de vapor y la temperatura no es lineal, la ecuación a menudo se reorganiza en forma logarítmica para producir la ecuación lineal:
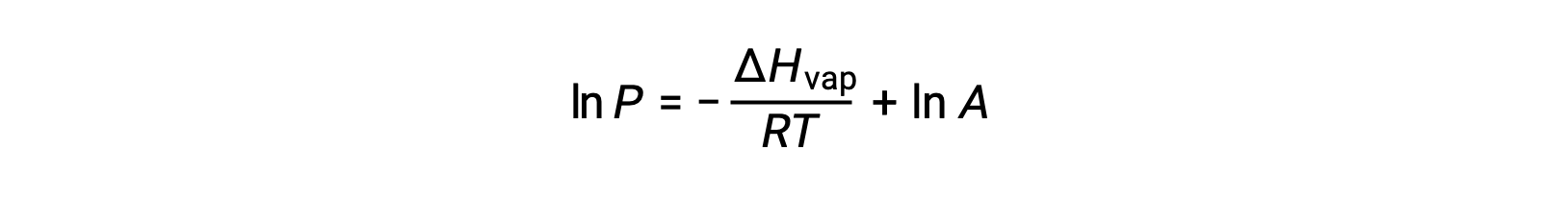
Para cualquier líquido, si se conoce la entalpía de la vaporización y la presión de vapor a una temperatura determinada, la ecuación de Clausius-Clapeyron permite determinar la presión de vapor del líquido a una temperatura diferente. Para ello, la ecuación lineal se puede expresar en un formato de dos puntos. Si a temperatura T1, la presión de vapor es P1, y a temperatura T2, la presión de vapor es P2, las ecuaciones lineales correspondientes son:
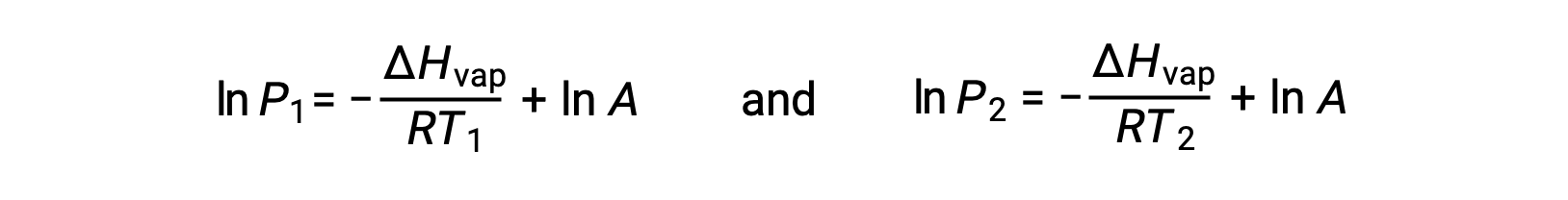
Dado que la constante, A, es la misma, estas dos ecuaciones se pueden reorganizar para aislar ln A y, a continuación, igualarlas entre sí:
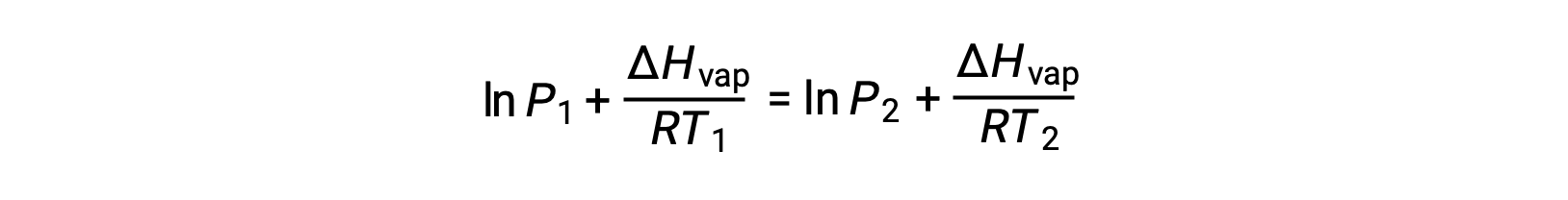
que se puede combinar en:
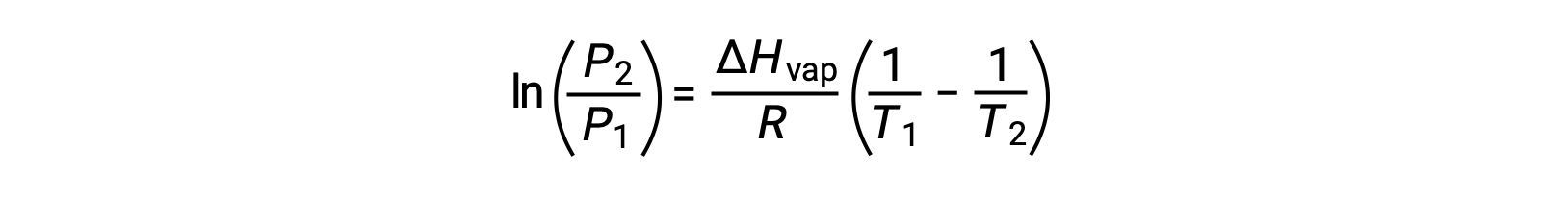
Este texto es adaptado de Openstax, Química 2e, Sección 10.3: Transiciones de Fase.
