11.9:
Equazione di Clausius-Clapeyron
11.9:
Equazione di Clausius-Clapeyron
L’equilibrio tra un liquido e il suo vapore dipende dalla temperatura del sistema; un aumento della temperatura provoca un corrispondente aumento della pressione di vapore del suo liquido. L’equazione di Clausius-Clapeyron fornisce la relazione quantitativa tra la pressione di vapore di una sostanza (P) e la sua temperatura (T); prevede la velocità con cui la pressione di vapore aumenta per unità di aumento della temperatura.
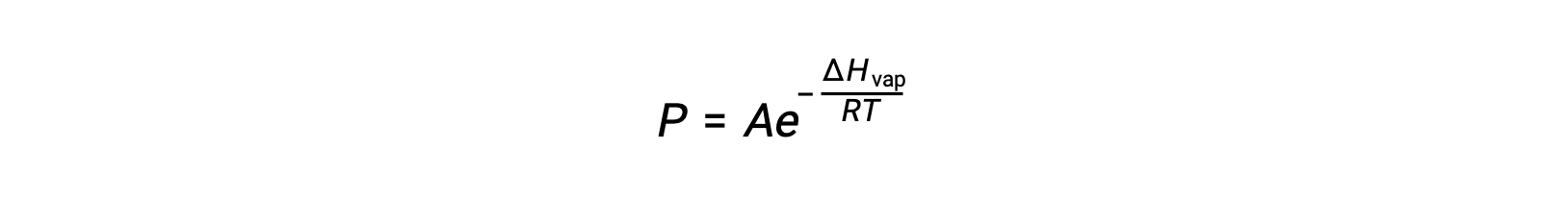
dove ΔHvap è l’entalpia di vaporizzazione per il liquido, R è la costante del gas, e A è una costante il cui valore dipende dall’identità chimica della sostanza. La temperatura (T) deve essere in kelvin in questa equazione. Tuttavia, poiché la relazione tra pressione di vapore e temperatura non è lineare, l’equazione è spesso riorganizzata in forma logaritmica per produrre l’equazione lineare:
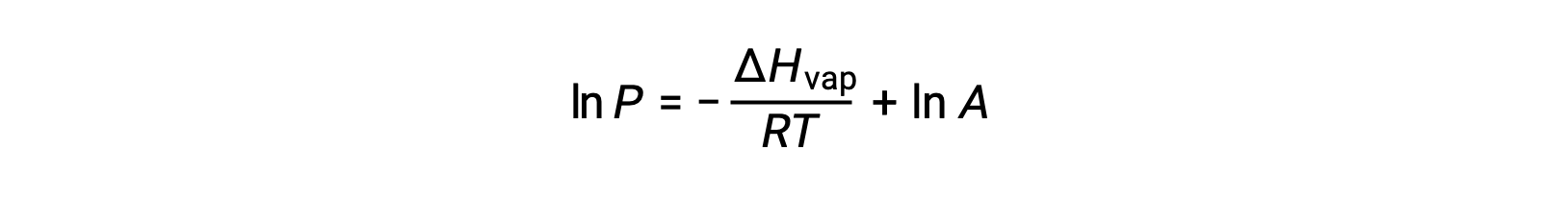
Per ogni liquido, se l’entalpia di vaporizzazione e pressione di vapore ad una particolare temperatura è nota, l’equazione di Clausius-Clapeyron permette di determinare la pressione di vapore del liquido ad una temperatura diversa. Per fare questo, l’equazione lineare può essere espressa in un formato a due punti. Se alla temperatura T1, la pressione di vapore è P1e alla temperatura T2, la pressione di vapore è P2, le corrispondenti equazioni lineari sono:
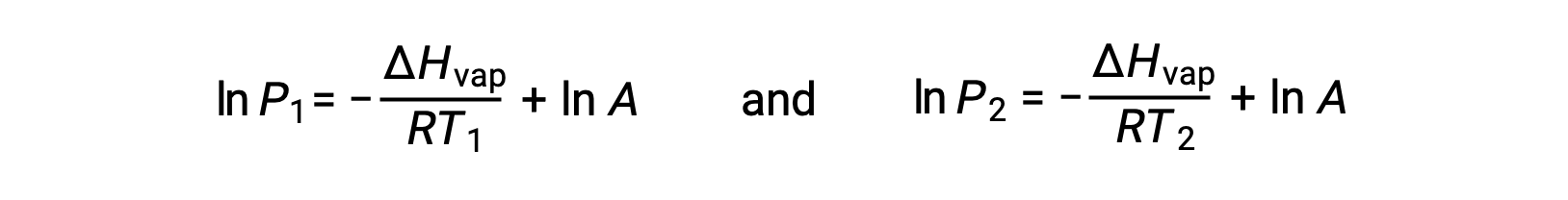
Poiché la costante Aè la stessa, queste due equazioni possono essere riorganizzate per isolare ln A e quindi impostarle uguali l’una all’altra:
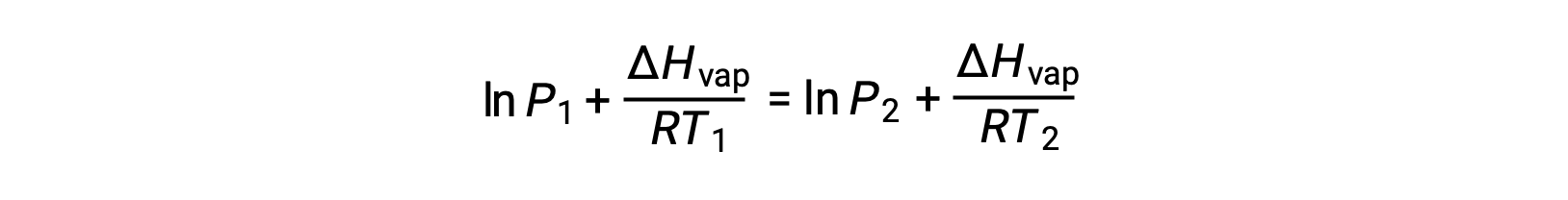
che può essere combinato in:
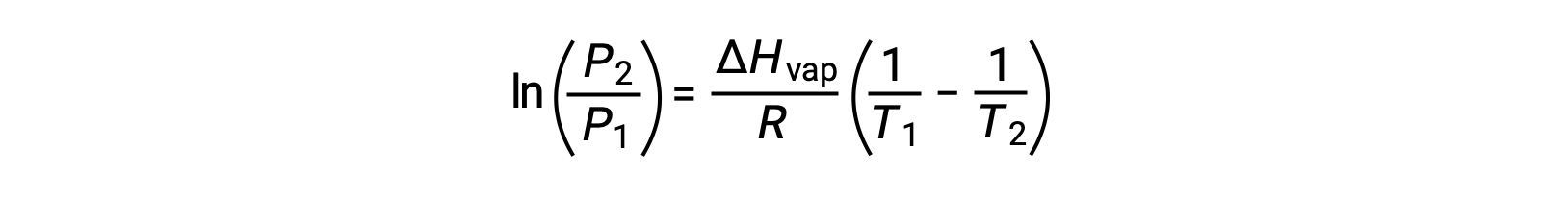
Questo testo è adattato da Openstax, Chemistry 2e, Sezione 10.3: Phase Transitions.
