11.13:
相图
11.13:
相图
相图将物质的液态气体,固体液体和固体气体相位过渡平衡的压力与温度相结合。 这些图显示了特定压力和温度条件下存在的物理状态,还提供了相位过渡温度 (熔化点,升华点,沸腾点) 的压力依赖性。 标有固体,液体和气体的区域或区域代表单相位,而线或曲线代表平衡中共存的两相位 (或相变点)。 三重点表示所有三相共存的压力和温度条件。 相比之下,临界点表示存在单相位 (其物理性质是气体和液体状态之间的中间相位) 的温度和压力高于该相位。
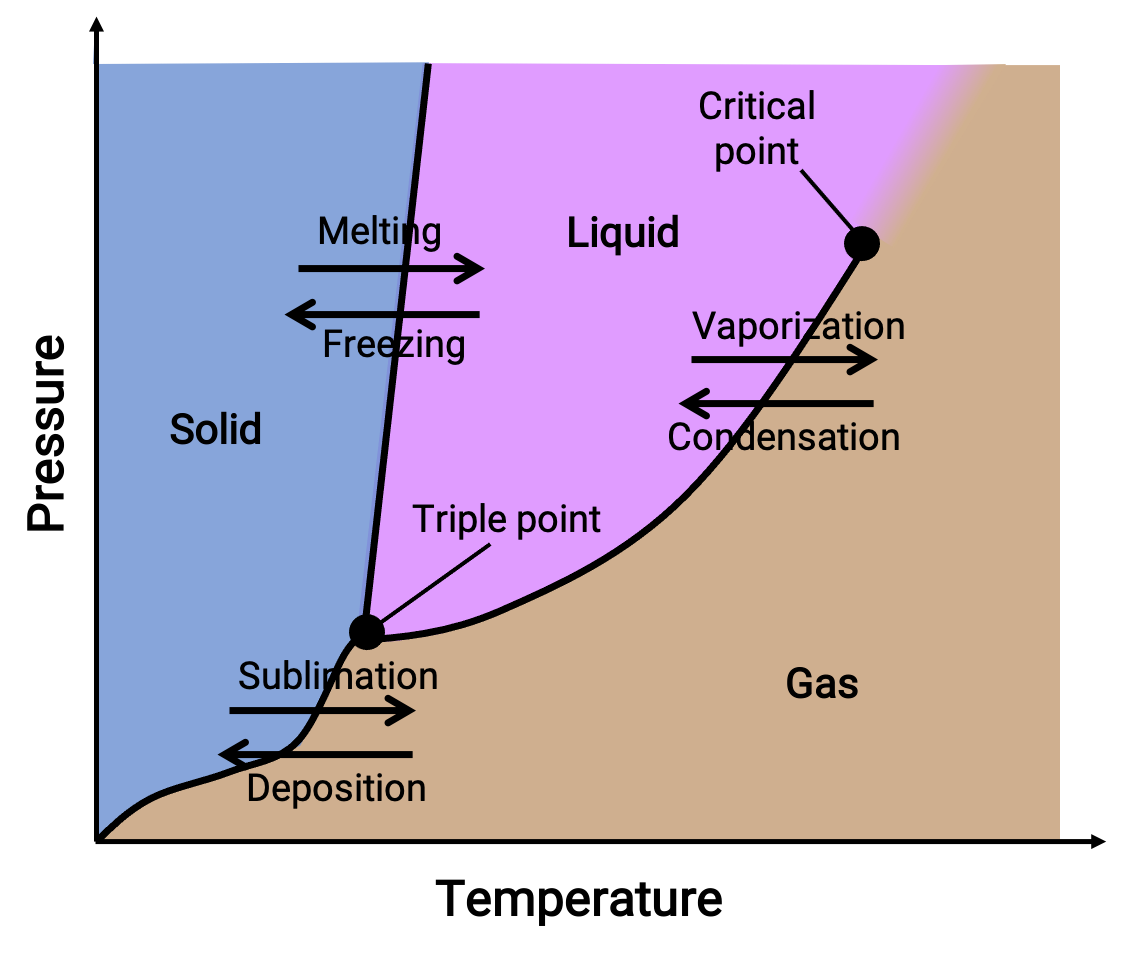
图 1. 典型的相图。
相图可识别特定压力和温度条件下物质的物理状态。 要说明这些图解的用途,请考虑水的相图,如下所示。
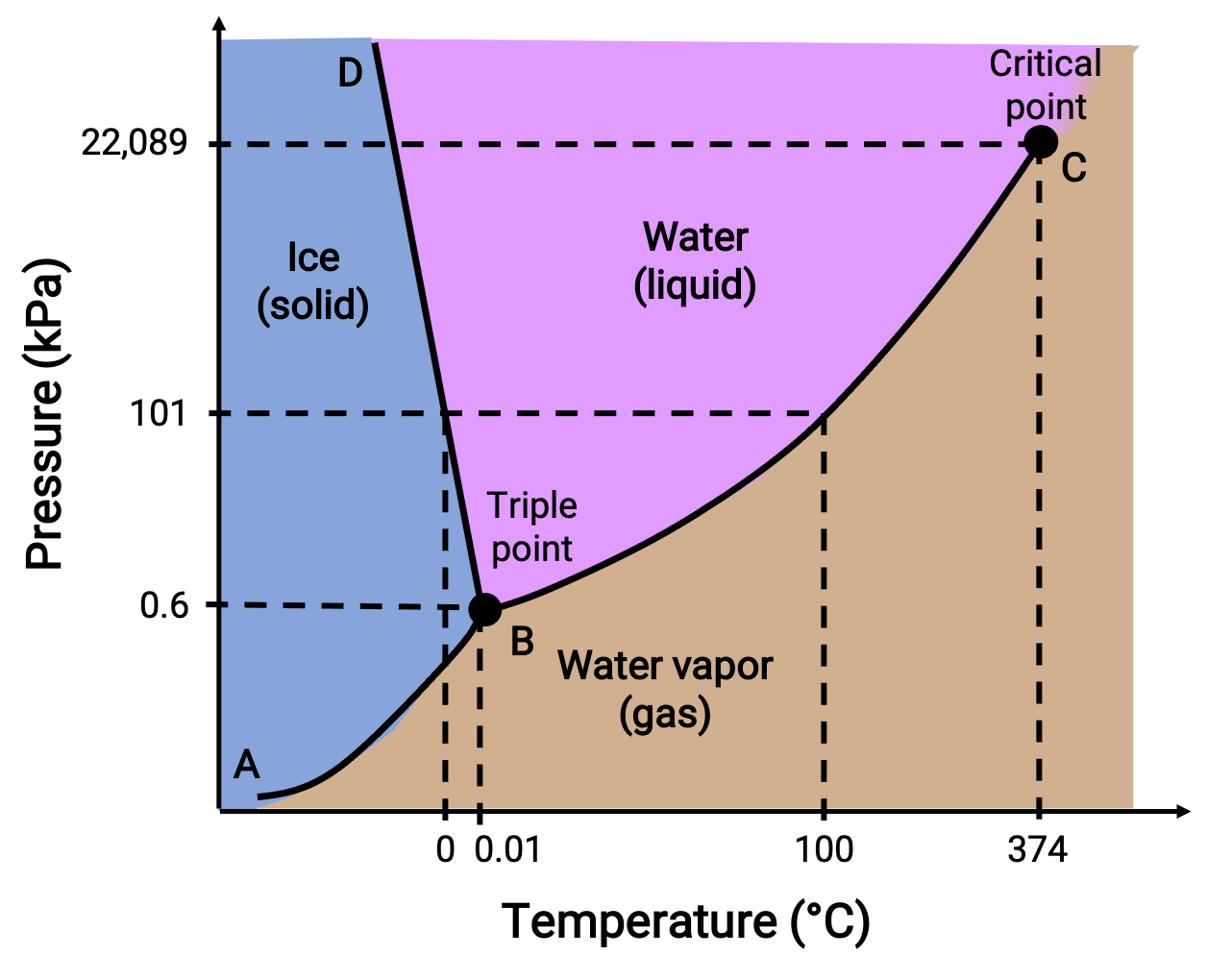
图 2. 水的相图。
50 千帕的压力和 −10 °C 的温度对应于标有“ ICE ”的图表区域。 在这种情况下,水只能作为固体存在。 50 kPa 的压力和 50 °C 的温度对应于水仅作为液体存在的区域。 在 25 千帕和 200 °C 时,只有气体状态下才有水。 BC 曲线是分离相图的液体和气体区域的液体蒸汽曲线,可在任何压力下为水提供沸点。 例如,在 1 atm 时,沸点为 100 °C 请注意,液体蒸汽曲线在温度为 374 °C 且压力为 218 atm 时终止,这表明水不能作为高于此温度的液体存在,无论压力如何。 在这些条件下,物理性质的水是其液体和气体相之间的中间体。 这种独特的物质状态被称为超临界流体。 标有 AB 的固体蒸气曲线表示冰和水蒸气处于平衡状态的温度和压力。 这些温度 – 压力数据对对应于水的升华或气相沉积点。
标有 BD 的固体液体曲线显示冰和液体水处于平衡状态的温度和压力,代表水的熔化 / 冻结点。 请注意,此曲线显示轻微的负斜率,表示水的熔点随着压力的增加而略有下降。 在这方面,水是一种异常物质,因为大多数物质的熔点随着压力的增加而增加。 所有三条曲线 (标有 B) 的交叉点都是水的三个点,三个相位在水的平衡中共存。 当压力低于三点时,水不能作为液体存在,无论温度如何。
另一个例子是二氧化碳相图。
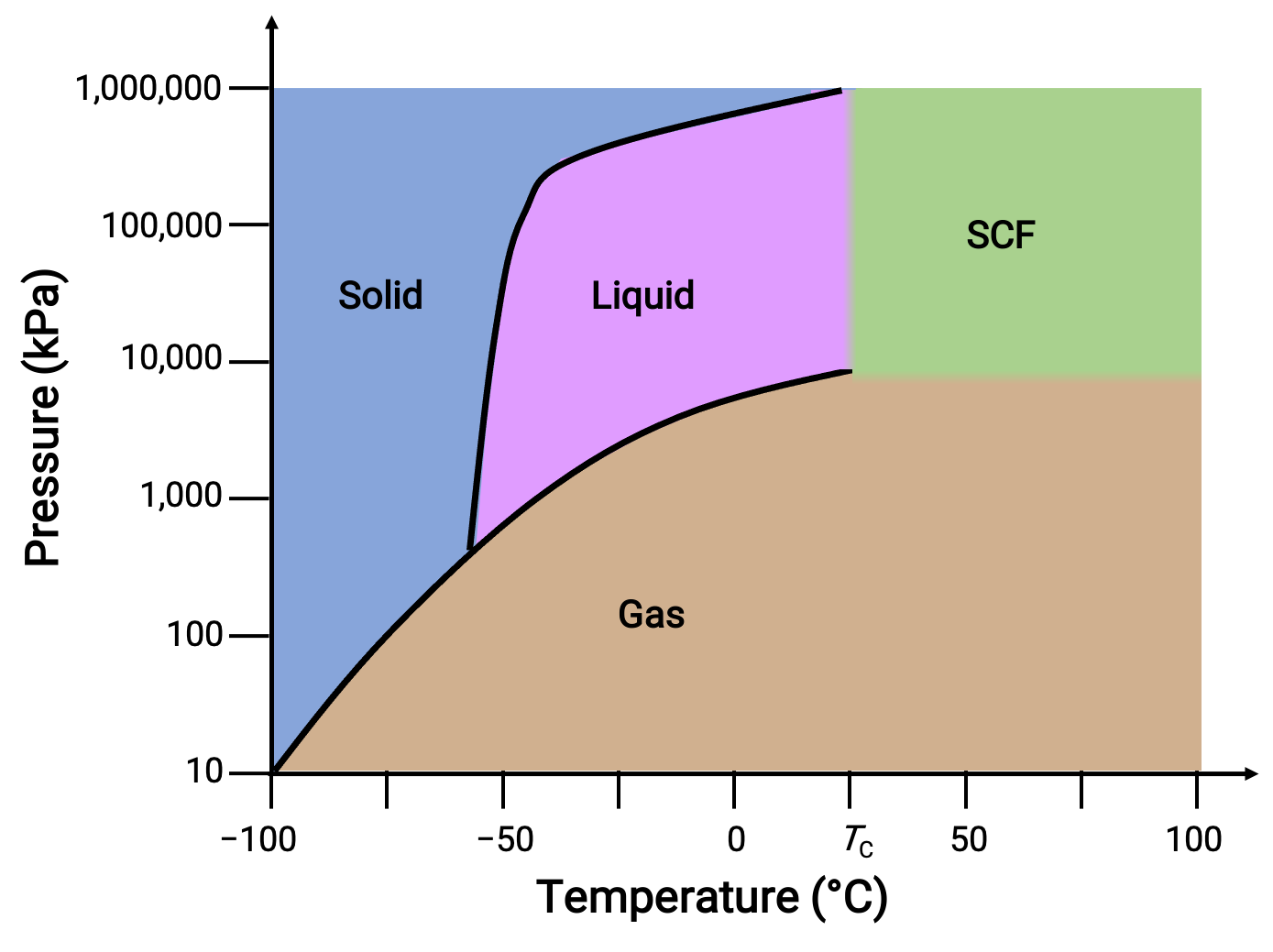
图 3. 二氧化碳的相图。
固体 – 液体曲线显示正斜率,表明 CO2 的熔点随着压力的增加而增加,这与大多数物质的情况相同。 请注意,三重点远高于 1 atm ,这表明在环境压力条件下,二氧化碳不能作为液体存在。 相反,以 1 atm 的温度冷却气体二氧化碳会导致其气相沉积进入固态状态。 同样,固体二氧化碳不会在 1 atm 压力下熔化,而是升华后产生气态二氧化碳。 最后,与水相比,二氧化碳的临界点是在相对温和的温度和压力下观测的。
本文改编自 Openstax, 化学 2e, 第10.4节:相图。
