11.13:
Diagramas de fase
11.13:
Diagramas de fase
Un diagrama de fase combina trazados de presión frente a temperatura para los equilibrios de transición de fase de líquido-gas, sólido-líquido y sólido-gas de una sustancia. Estos diagramas indican los estados físicos que existen en condiciones específicas de presión y temperatura y también proporcionan la dependencia de la presión de las temperaturas de transición de fase (puntos de fusión, puntos de sublimación, puntos de ebullición). Las regiones o áreas etiquetadas como sólido, líquido y gas representan fases únicas, mientras que las líneas o curvas representan dos fases coexistentes en equilibrio (o puntos de cambio de fase). El punto triple indica las condiciones de presión y temperatura en las que coexisten las tres fases. Por el contrario, un punto crítico indica la temperatura y la presión por encima de las cuales existe una única fase, cuyas propiedades físicas son intermedias entre los estados gaseoso y líquido.
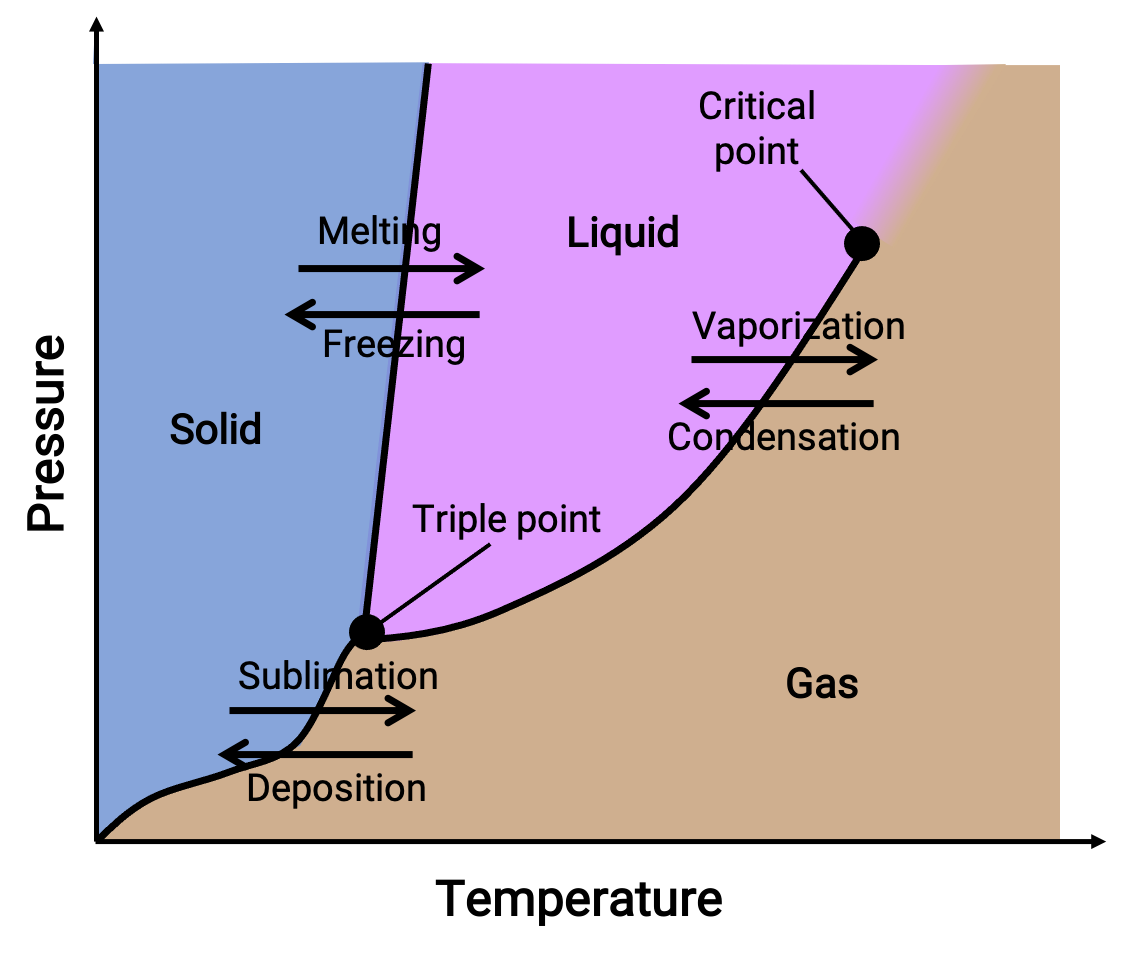
Figura 1. Un diagrama de fase típico.
Un diagrama de fase identifica el estado físico de una sustancia en condiciones específicas de presión y temperatura. Para ilustrar la utilidad de estas representaciones, considere el diagrama de fase del agua, que se muestra a continuación.
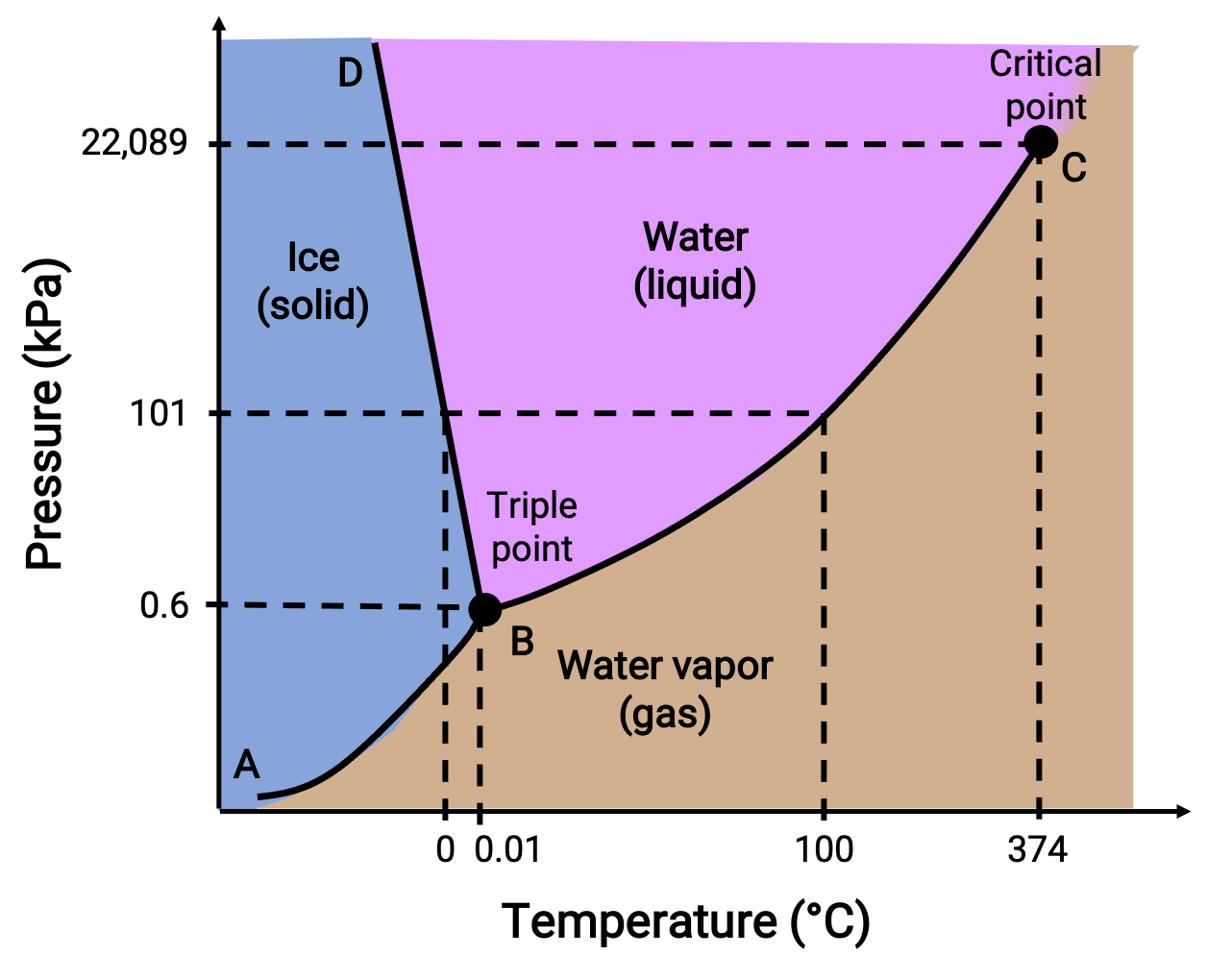
Figura 2. Diagrama de fase del agua.
Una presión de 50 kPa y una temperatura de −10 °C corresponde a la región del diagrama denominada “ice”. Bajo estas condiciones, el agua existe sólo como un sólido. Una presión de 50 kPa y una temperatura de 50 °C corresponde a la región donde el agua existe sólo como líquido. A 25 kPa y 200 °C, el agua sólo existe en estado gaseoso. La curva BC es la curva de vapor-líquido que separa las regiones líquida y gaseosa del diagrama de fase y proporciona el punto de ebullición del agua a cualquier presión. Por ejemplo, a 1 atm, el punto de ebullición es de 100 °C. Observe que la curva de vapor líquido termina a una temperatura de 374 °C y una presión de 218 atm, lo que indica que el agua no puede existir como líquido por encima de esta temperatura, independientemente de la presión. Las propiedades físicas del agua en estas condiciones son intermedias entre las de sus fases líquida y gaseosa. Este estado único de la materia se llama fluido supercrítico. La curva de vapor sólido con la etiqueta AB indica las temperaturas y presiones a las que el hielo y el vapor de agua están en equilibrio. Estos pares de datos temperatura-presión corresponden a los puntos de sublimación o deposición del agua.
La curva de líquido-sólido con la etiqueta BD muestra las temperaturas y presiones a las que el hielo y el agua líquida están en equilibrio, lo que representa los puntos de fusión/congelación del agua. Tenga en cuenta que esta curva muestra una ligera pendiente negativa, lo que indica que el punto de fusión del agua disminuye ligeramente a medida que aumenta la presión. El agua es una sustancia inusual en este sentido, ya que la mayoría de las sustancias presentan un aumento en el punto de fusión con una presión creciente. El punto de intersección de las tres curvas—etiquetado como B— es el punto triple del agua, donde las tres fases coexisten en equilibrio. A presiones inferiores al punto triple, el agua no puede existir como líquido, independientemente de la temperatura.
Considere el diagrama de fase del dióxido de carbono como otro ejemplo.
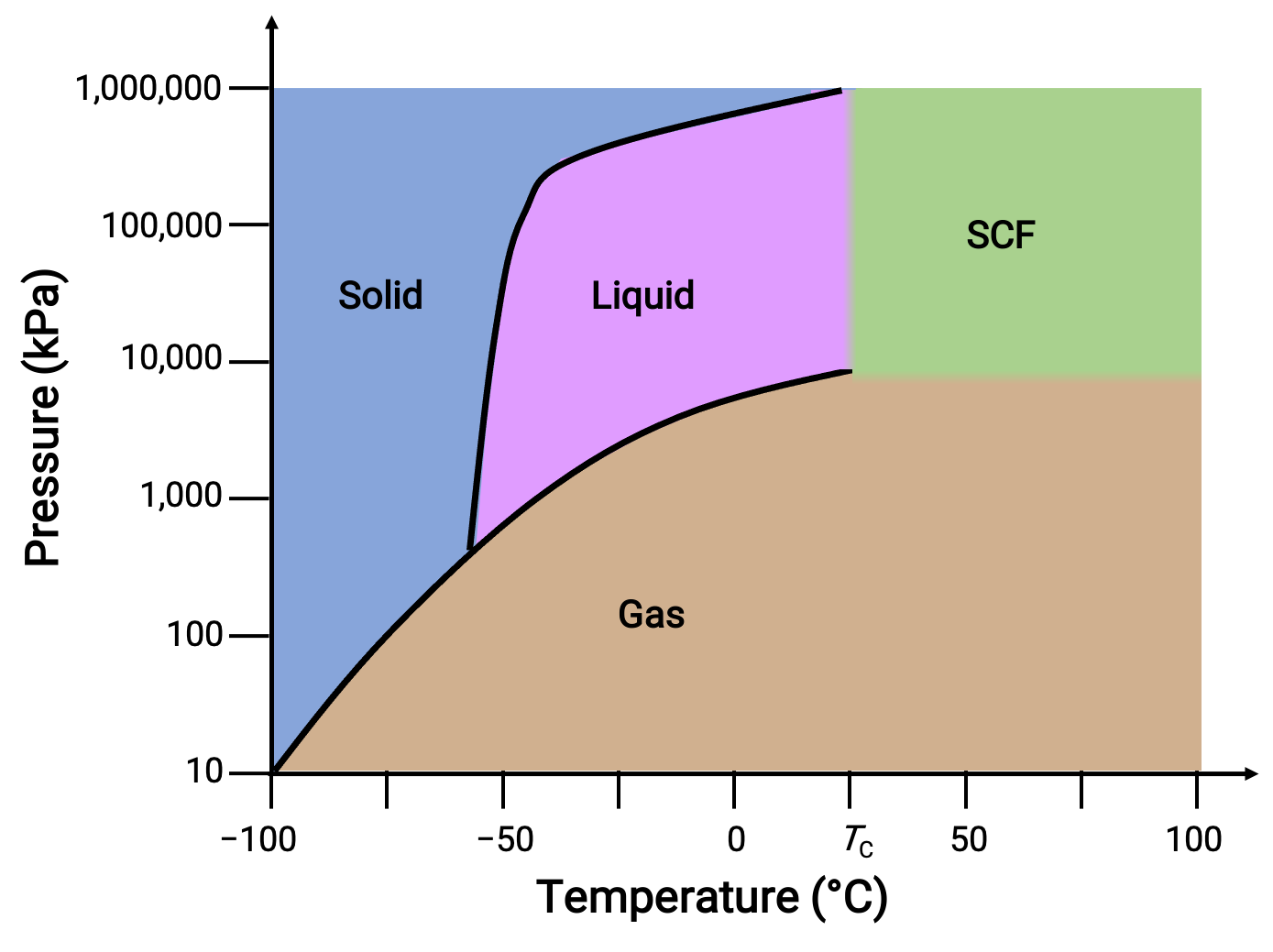
Figura 3.Diagrama de fase del dióxido de carbono.
La curva sólido-líquido presenta una pendiente positiva, lo que indica que el punto de fusión para CO2 aumenta con la presión como lo hace para la mayoría de las sustancias. Observe que el punto triple está muy por encima de 1 atm, lo que indica que el dióxido de carbono no puede existir como líquido bajo condiciones de presión ambiental. En cambio, enfriar el dióxido de carbono gaseoso a 1 atm resulta en su deposición en estado sólido. Del mismo modo, el dióxido de carbono sólido no se derrite a una presión de 1 atm, sino que se sublima para producir CO2 gaseoso. Finalmente, el punto crítico para el dióxido de carbono se observa a una temperatura y presión relativamente modestas en comparación con el agua.
Este texto es adaptado de Openstax, Química 2e, Sección 10.4: Diagramas de Fase.
