11.13:
Diagrammes de phases
11.13:
Diagrammes de phases
Un diagramme de phases combine les tracés de la pression par rapport à la température pour les équilibres de transition de phases liquide-gaz, solide-liquide et solide-gaz d’une substance. Ces diagrammes indiquent les états physiques qui existent dans des conditions spécifiques de pression et de température et ils fournissent également la dépendance de pression pour les températures de transition de phases (points de fusion, points de sublimation, points d’ébullition). Les régions ou les zones notées solide, liquide et gaz représentent des phases seules, tandis que les lignes ou les courbes représentent deux phases coexistantes en équilibre (ou points de changement de phase). Le point triple indique les conditions de pression et de température auxquelles les trois phases coexistent. En revanche, un point critique indique la température et la pression au-dessus desquelles il existe une seule phase dont les propriétés physiques sont intermédiaires entre les états gazeux et liquide.
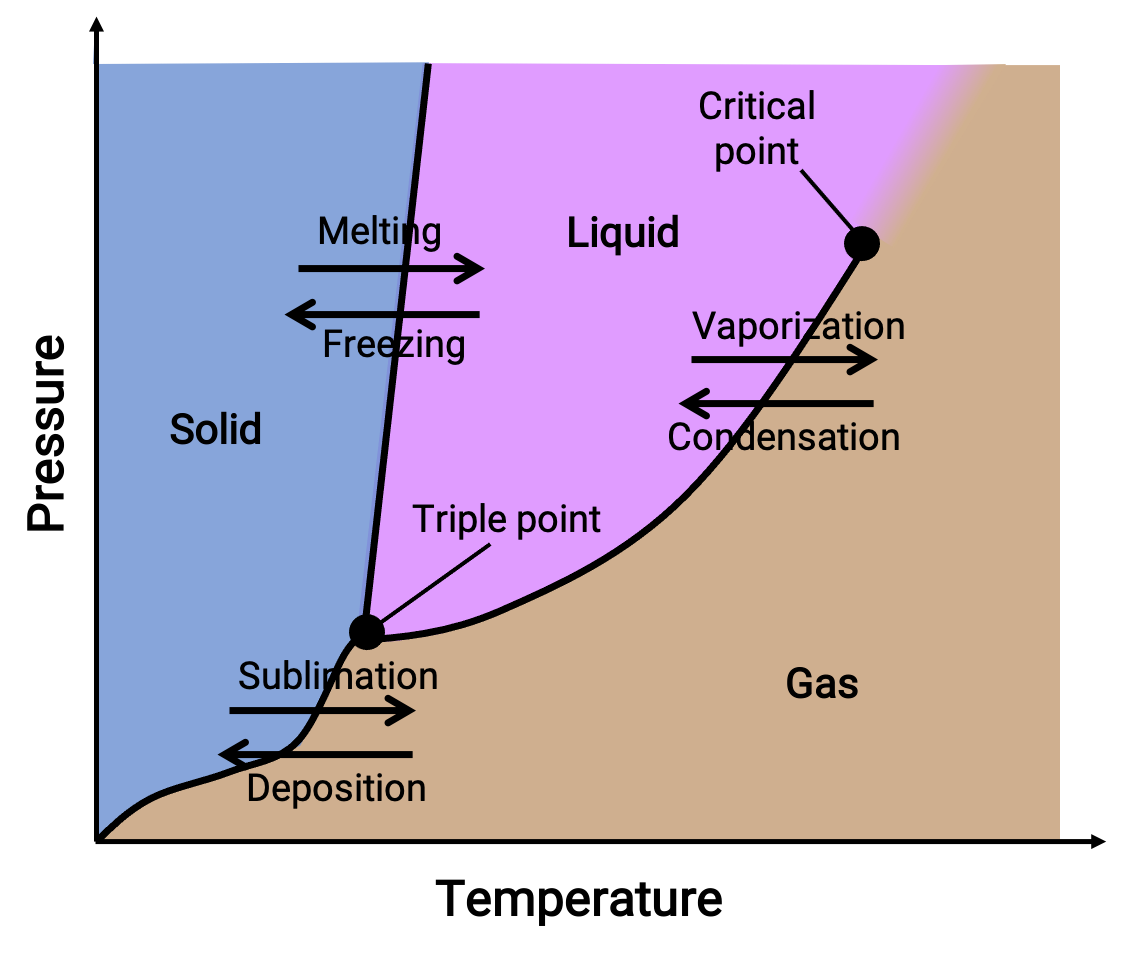
Figure 1. Diagramme de phases type.
Un diagramme de phases identifie l’état physique d’une substance dans des conditions de pression et de température spécifiées . Pour illustrer l’utilité de ces graphes, examinez le diagramme de phases de l’eau, illustré ci-dessous.
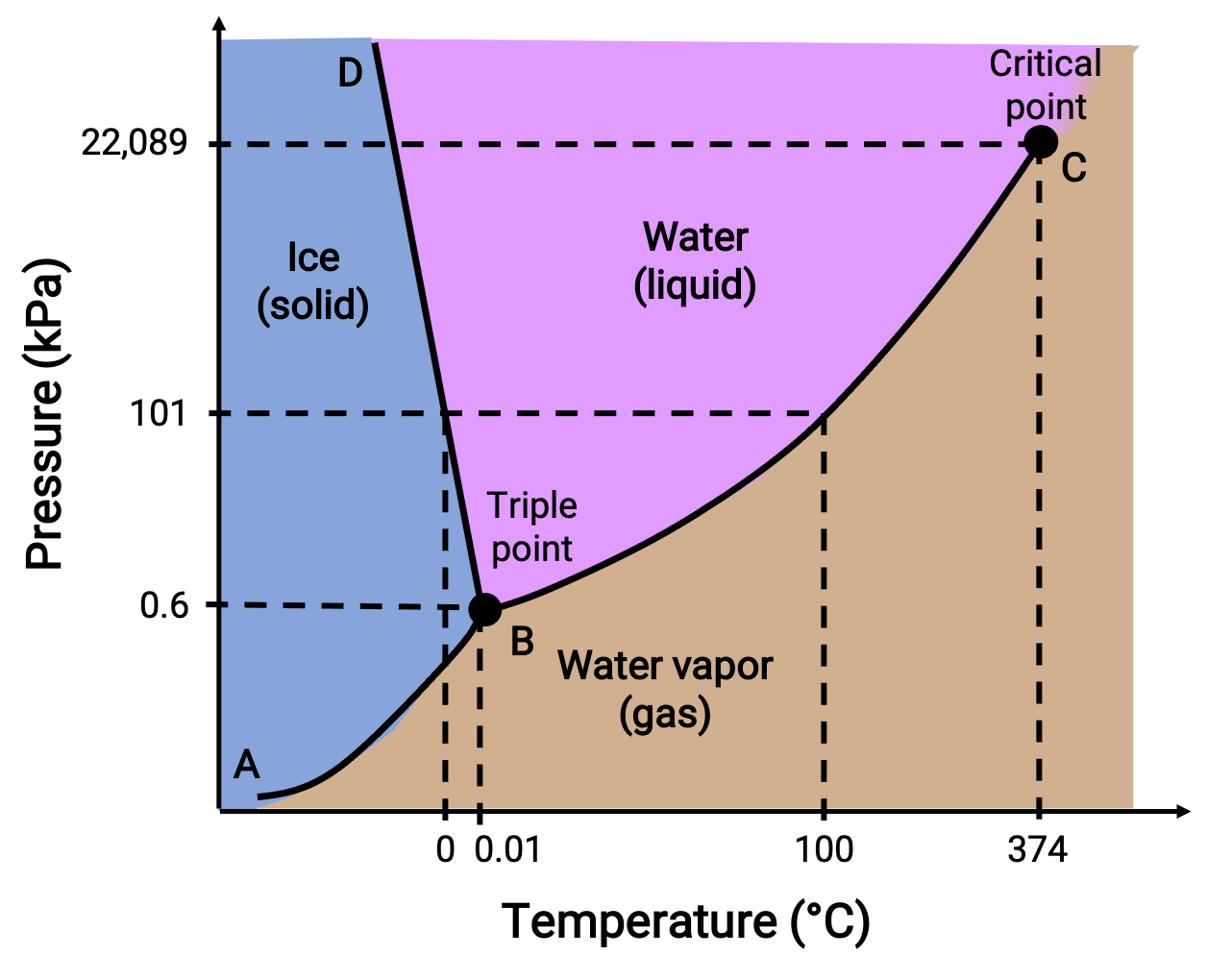
Figure 2. Diagramme de phases de l’eau.
Une pression de 50 kPa et une température de −10 °C correspondent à la région du diagramme notée “ GLACE ”. Dans ces conditions, l’eau n’existe qu’en tant que solide. Une pression de 50 kPa et une température de 50 °C correspondent à la région où l’eau n’existe qu’en tant que liquide. À 25 kPa et 200 °C, l’eau n’existe qu’à l’état gazeux. La courbe BC est la courbe liquide-vapeur séparant les régions liquide et gazeuse du diagramme de phases et fournit le point d’ébullition de l’eau à n’importe quelle pression. Par exemple, à 1 atm, le point d’ébullition est de 100 °C. Notez que la courbe liquide-vapeur se termine à une température de 374 °C et une pression de 218 atm, ce qui indique que l’eau ne peut pas exister en tant que liquide au-dessus de cette température, quelle que soit la pression. Les propriétés physiques de l’eau dans ces conditions sont intermédiaires entre celles de ses phases liquide et gazeuse. Cet état de matière unique est appelé fluide supercritique. La courbe solide-vapeur notée AB indique les températures et les pressions auxquelles la glace et la vapeur d’eau sont en équilibre. Ces couples de données température-pression correspondent aux points de sublimation ou de dépôt de l’eau.
La courbe solide-liquide notée BD indique les températures et les pressions auxquelles la glace et l’eau liquide sont en équilibre, représentant les points de fusion/congélation de l’eau. Notez que cette courbe présente une pente légèrement négative, ce qui indique que le point de fusion de l’eau diminue légèrement à mesure que la pression augmente. L’eau est une substance inhabituelle à cet égard, car la plupart des substances présentent une augmentation du point de fusion lorsque la pression augmente. Le point d’intersection des trois courbes, marqué B, est le point triple de l’eau, où les trois phases coexistent en équilibre. À des pressions inférieures au point triple, l’eau ne peut pas exister en tant que liquide, quelle que soit la température.
Considérons le diagramme de phases pour le dioxyde de carbone comme autre exemple.
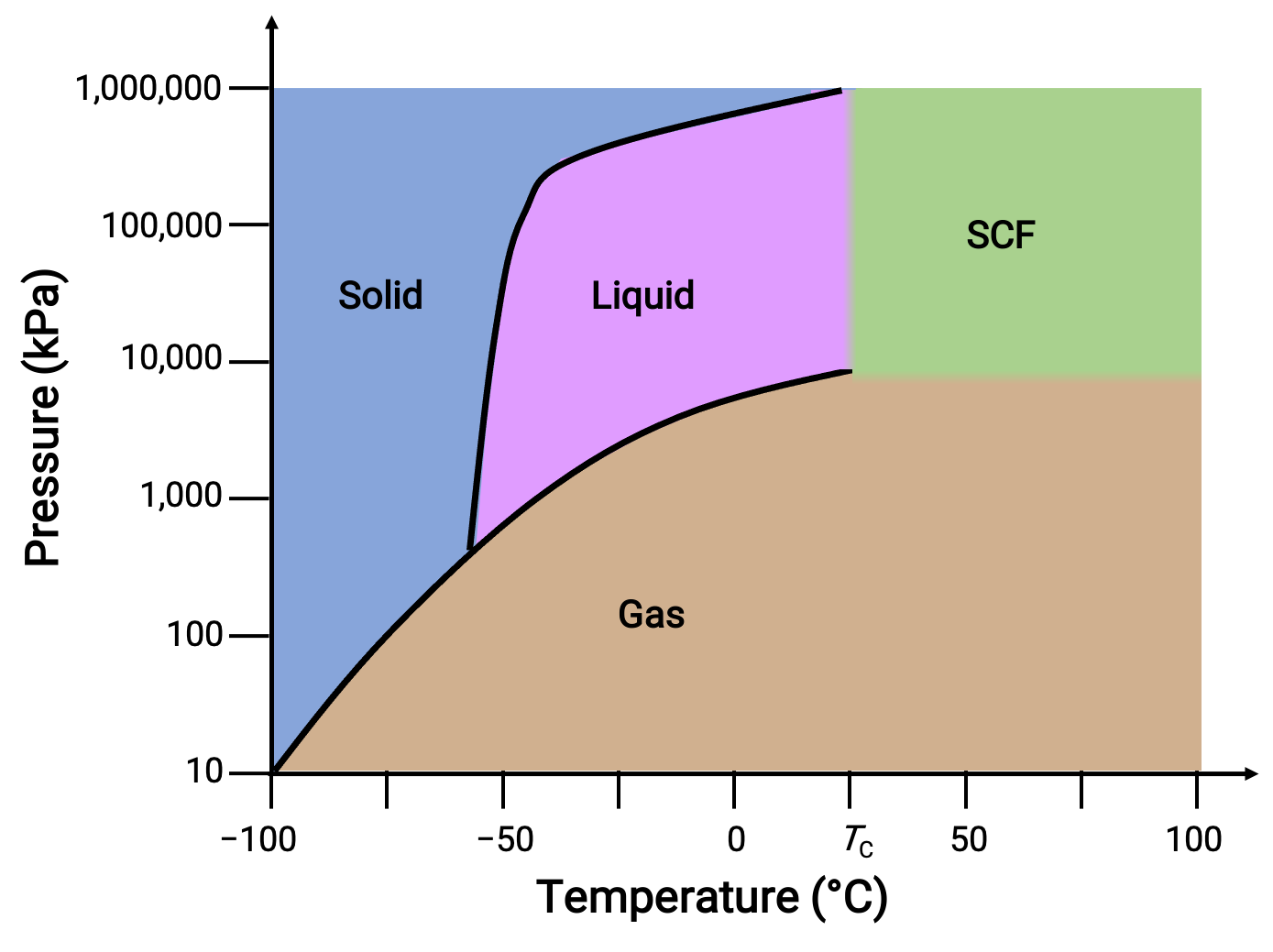
Figure 3. Diagramme de phases du dioxyde de carbone.
La courbe solide-liquide présente une pente positive, ce qui indique que le point de fusion du CO2 augmente avec la pression comme pour la plupart des substances. Notez que le point triple est bien au-dessus de 1 atm, ce qui indique que le dioxyde de carbone ne peut pas exister en tant que liquide dans des conditions de pression ambiante. Au lieu de cela, le refroidissement du dioxyde de carbone gazeux à 1 atm entraîne son dépôt à l’état solide. De même, le dioxyde de carbone solide ne fond pas à une pression de 1 atm, mais se sublime pour produire du CO2 gazeux. Enfin, le point critique du dioxyde de carbone est observé à une température et une pression relativement modestes par rapport à l’eau.
Ce texte est adapté de Openstax, Chimie 2e, Section 10.4 : Diagrammes de phases.
