11.13:
상평형 그림
11.13:
상평형 그림
위상 다이어그램은 액체 가스, 고체 액체 및 물질의 고체 가스 위상 전이 평형에 대한 압력 대 온도를 결합합니다. 이러한 다이어그램은 압력 및 온도의 특정 조건하에서 존재하는 물리적 상태를 나타내며 위상 전이 온도(녹는 점, 승화점, 비등점)의 압력 의존도도를 제공합니다. 고체, 액체 및 가스로 표시된 영역은 단일 단계를 나타내며, 라인 또는 곡선은 평형(또는 위상 변경 점)에서 공존하는 두 단계를 나타냅니다. 세 번째 점은 세 단계가 모두 공존하는 압력 및 온도 조건을 나타냅니다. 반면, 임계점은 기체 와 액체 상태 사이의 물리적 특성이 중간인 단일 상 위의 온도와 압력을 나타냅니다.
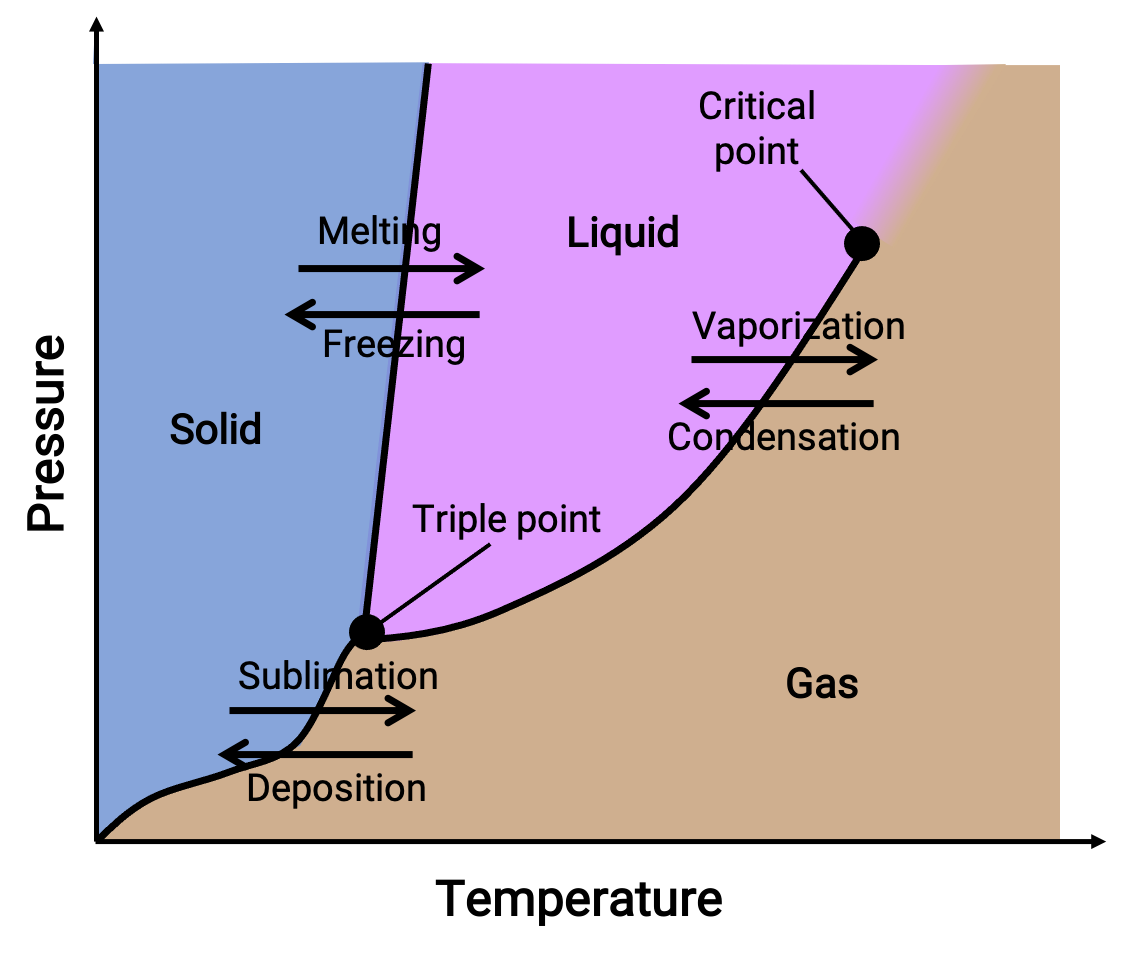
그림 1. 일반적인 위상 다이어그램입니다.
위상 다이어그램은 지정된 압력 및 온도 조건하에서 물질의 물리적 상태를 식별합니다. 이러한 플롯의 유용성을 설명하려면 아래와 같이 물의 위상 다이어그램을고려하십시오.
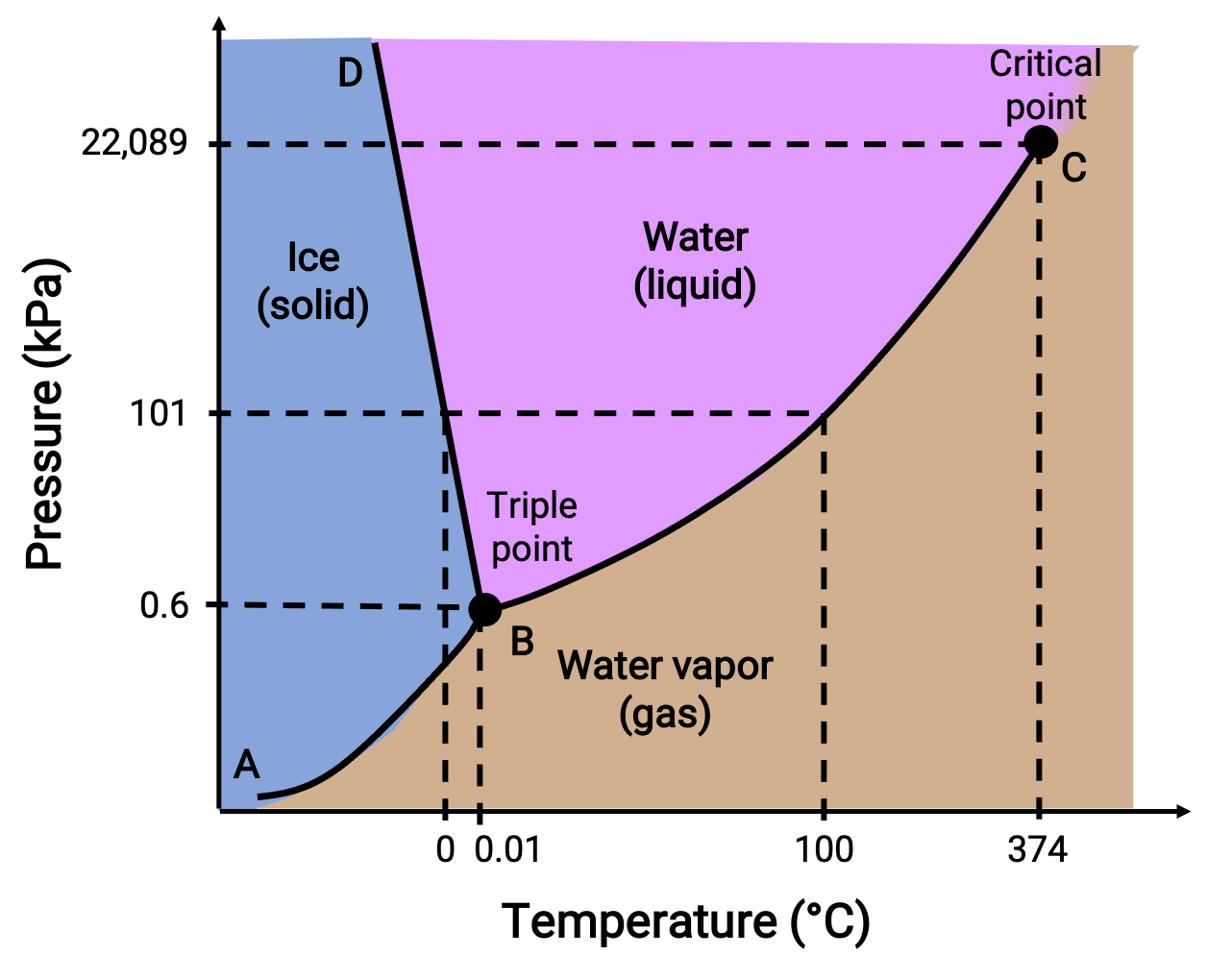
그림 2. 물의 위상 다이어그램.
50 kPa의 압력과 -10 °C의 온도는 “얼음”이라고 표시된 다이어그램의 영역에 해당합니다. 이러한 조건에서 물은 고체로만 존재합니다. 50 kPa의 압력과 50 °C의 온도는 물이 액체로만 존재하는 영역에 해당합니다. 25 kPa 및 200°C에서 물은 기체 상태에서만 존재합니다. 커브 BC는 위상 다이어그램의 액체 및 기체 영역을 분리하는 액체 증기 곡선이며 임의의 압력에서 물에 대한 비등점을 제공합니다. 예를 들어, 1 atm에서 비등점은 100 °C입니다. 액체 증기 곡선은 374°C의 온도와 218 atm의 압력으로 종료되며, 이는 압력에 관계없이 이 온도 이상의 액체로 물이 존재할 수 없음을 나타냅니다. 이러한 조건 하에서 물의 물리적 특성은 액체와 기체 단계 사이의 중간입니다. 이 독특한 물질 상태는 초임계 유체라고 합니다. AB라고 표시된 고체 증기 곡선은 얼음과 수증기가 평형에 있는 온도와 압력을 나타냅니다. 이러한 온도 압력 데이터 쌍은 물의 승화 또는 증착 지점에 해당합니다.
BD로 표시된 고체 액체 곡선은 얼음과 액체 물이 평형에 있는 온도와 압력을 나타내며, 이는 물의 용융/동결 지점을 나타냅니다. 이 곡선은 약간의 음의 경사를 나타내며, 이는 압력이 증가함에 따라 물의 융점이 약간 감소한다는 것을 나타냅니다. 물은 대부분의 물질이 증가 압력과 융점의 증가를 나타내기 때문에,이 점에서 특이한 물질이다. B라고 표시된 세 곡선의 교차점은 3단계 모두 평형에 공존하는 물의 세 배지점입니다. 삼중점보다 낮은 압력에서는 온도에 관계없이 물이 액체로 존재할 수 없습니다.
이산화탄소의 위상 다이어그램을 또 다른 예로 고려하십시오.
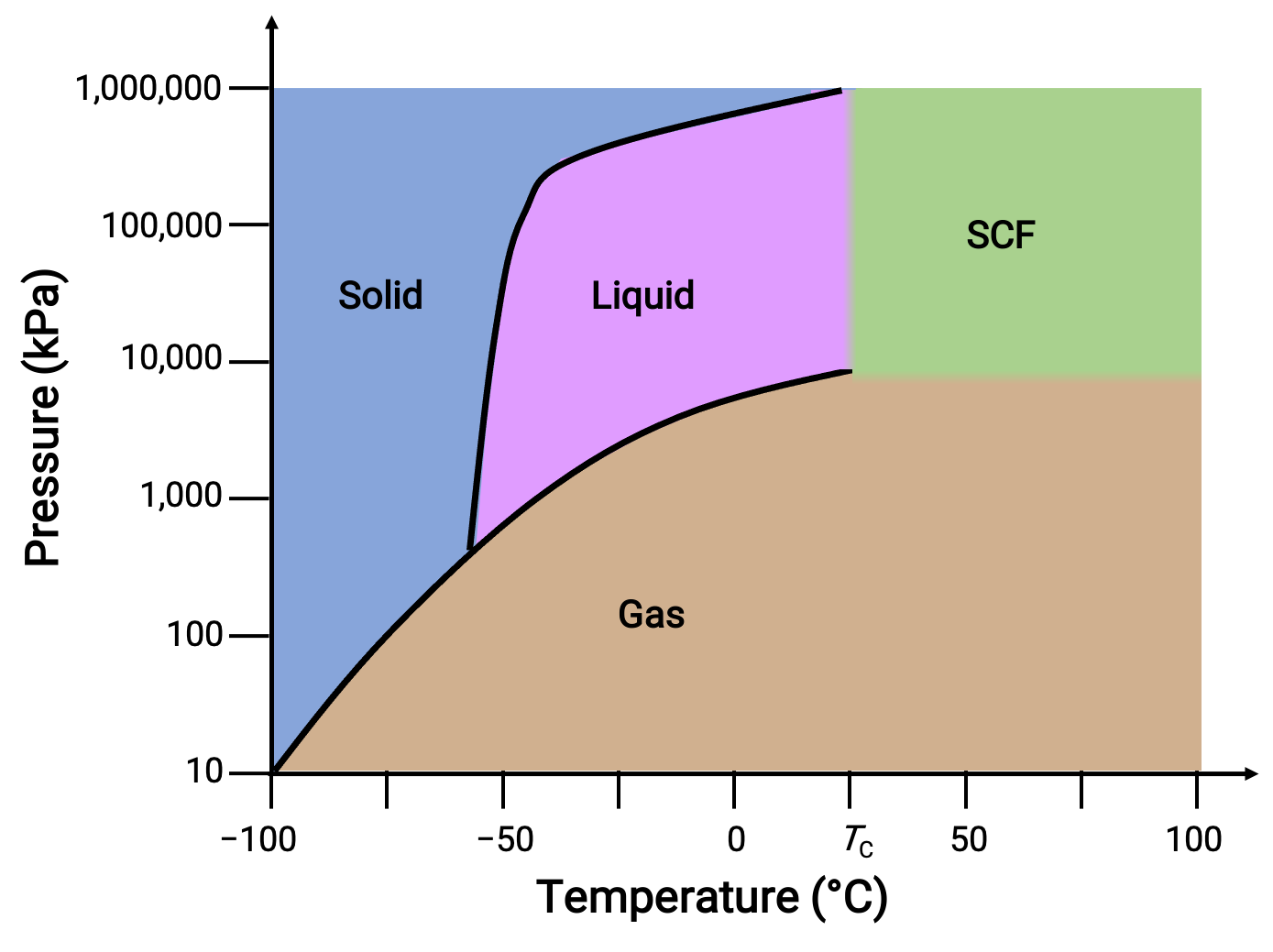
그림 3. 이산화탄소의 위상 다이어그램.
고체 액체 곡선은 양수 경사를 나타내며, 이는 CO2의 융점이 대부분의 물질과 마찬가지로 압력으로 증가한다는 것을 나타냅니다. 삼중 점은 1atm 보다 훨씬 높으며, 이는 이산화탄소가 주변 압력 조건에서 액체로 존재할 수 없음을 나타냅니다. 대신, 1 atm에서 냉각 기체 이산화탄소는 고체 상태로 증착결과. 마찬가지로, 고체 이산화탄소는 1 atm 압력에서 녹지 않고 대신 기체 CO2를산출하는 숭고한. 마지막으로, 이산화탄소의 임계점은 물에 비해 상대적으로 낮은 온도와 압력에서 관찰됩니다.
