12.8:
蒸汽压降低
A subscription to JoVE is required to view this content. Sign in or start your free trial.
JoVE Core
Chemistry
Vapor Pressure Lowering
溶液的某些性质取决于溶质的类型。盐酸水溶液 使 pH 试纸变成红色,而氢氧化钠溶液使 pH 纸 变成蓝色。溶液的其他性质只 取决于溶质的浓度或颗粒数量,而不是溶质的类型。这些被称为依数性质。一种这样的性质是溶液的蒸气压。液体的蒸气压是指 在密闭容器中液体和气体处于动态平衡状态时,由于蒸发而产生的液体上方的 气体压力。溶液的蒸气压 始终小于纯溶剂的蒸气压。考虑在将非挥发性溶质 即没有可测量的蒸气压力)添加到挥发性溶剂中时制得的溶液。在纯溶剂中,液体的整个表面都是 溶剂颗粒。这些粒子中的一些逃逸进入气态,从而产生蒸气,而上方的某些气体分子 会凝结回到液态。当蒸发速率等于 冷凝速率时,达到动态平衡。在溶液中,液体表面 既有溶质颗粒又有溶剂颗粒。因此,较少数量的表面溶剂颗粒 可以蒸发。冷凝速率降低,以与降低的蒸发速率 重新建立动态平衡,现在气体状态下的 溶剂颗粒浓度较低。溶液的蒸气压可以 通过拉乌尔定律来计算,该定律指出溶液的分压 等于溶剂的摩尔分数 chi 乘以纯溶剂的蒸气压 P naught。例如,25°C 下,溶液中含有 1.5 摩尔的非挥发性 溶质(如甘油)和 3.5 摩尔的水。溶剂的摩尔分数为 0.70,纯水的蒸气压为 23.8 托。可以使用拉乌尔定律 计算得出溶液的蒸气压 为 16.7 托,是纯溶剂蒸气压的 70%蒸气压降低 ΔP 的方程式 也可以从拉乌尔定律得出。由于溶剂的摩尔分数 等于 1 减去溶质的摩尔分数,因此可以将其代入拉乌尔定律。这可用于创建一个方程,其中蒸汽压降 与溶质的摩尔分数成正比。回顾前面的例子,溶质的摩尔分数 是 1 减去溶剂的摩尔分数。插入该值,得出溶质的摩尔分数为 0.3。假设纯水的蒸气压为 23.8 托,则计算得出蒸气压降为 7.14 托。将 ΔP 与溶液的蒸气压相加,即可获得纯溶剂的蒸气压。
12.8:
蒸汽压降低
液体的平衡蒸汽压是当汽化和凝结以相同速率发生时其气体相施加的压力:
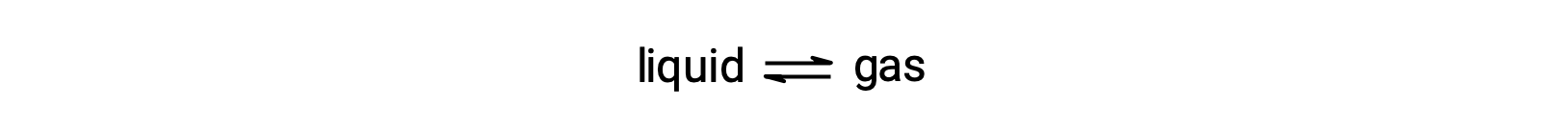
溶解挥发液体中的非挥发性物质会导致液体的蒸汽压下降。 这种现象可以通过考虑添加的溶质分子对液体汽化和凝结过程的影响来解释。 要汽化,溶剂分子必须存在于溶液表面。 溶质的存在会减小溶剂分子的表面面积,从而降低溶剂汽化的速率。 由于凝结的速率不受存在溶质的影响,因此产生的净结果是,汽化 – 冷凝平衡是在汽相 (即在较低蒸汽压下) 溶剂分子较少的情况下实现的。
虽然这种解释很有用,但它并没有说明蒸汽压下降的协作性质的几个重要方面。 更严格的解释涉及熵的属性。 为了了解液体蒸汽压的下降情况,可以注意到,与分离溶剂和溶质相相比,溶液中物质的分散性越强,可以有效稳定溶剂分子并阻碍其汽化。 蒸汽压结果越低,沸点越高。
拉乌尔定律(Raoult’s law) 描述了溶液组件的蒸汽压力与这些组件的浓度之间的关系:理想溶液的任何组件施加的部分压力等于纯组件的蒸汽压乘以溶液中的摩尔分数。
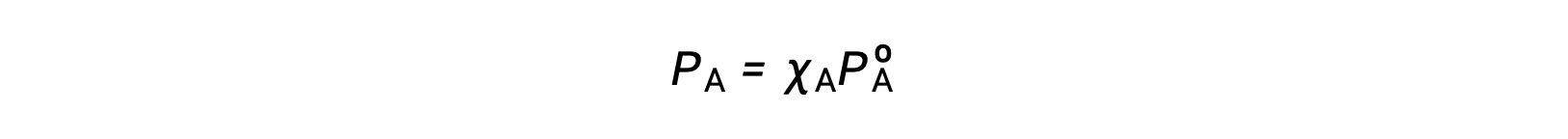
其中 PA 是溶液中组件 A 施加的部分压力, PºA 是纯 A 的蒸汽压,而 XA 是溶液中组件 A 的摩尔分数。
回顾气体混合物的总压力等于其所有成分 (道尔顿分压定律) 的分压总和,含 I 成分的溶液施加的总蒸汽压为:
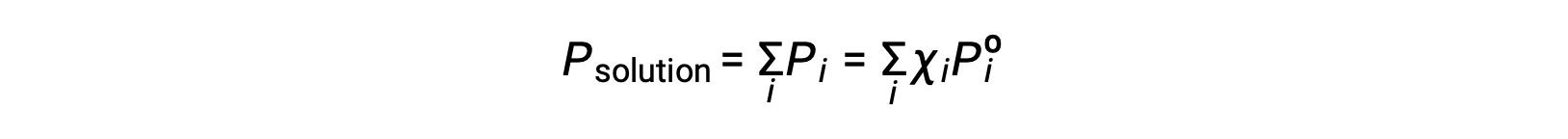
非挥发性物质是其蒸汽压可忽略不计的物质 (Pº ≈ 0) ,因此,仅含非挥发性溶质的溶液上方的蒸汽压仅由溶剂引起:
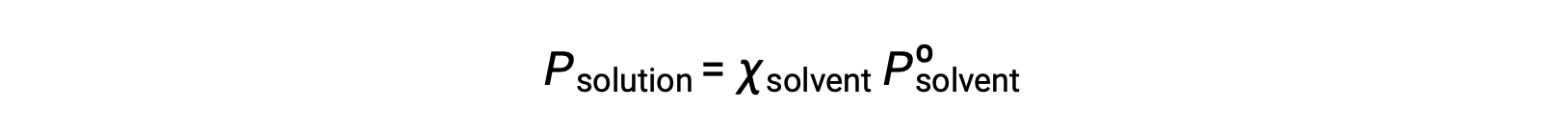
Suggested Reading
- Andrews, Frank C. "Colligative properties of simple solutions." Science 194, no. 4265 (1976): 567-571.
- Lindsay Jr, W. T., and Chu Tisin Liu. “Vapor pressure lowering of aqueous solutions at elevated temperatures.” Westinghouse Research Laboratories, Pittsburgh, Pennsylvania, 1968.
- Chinard, Francis P. "Colligative properties." Journal of Chemical Education 32, no. 7 (1955): 377.
