12.8: Abaissement de la pression de vapeur saturante
La pression de vapeur à l'équilibre d'un liquide est la pression exercée par sa phase gazeuse lorsque la vaporisation et la condensation se produisent à des vitesses égales :
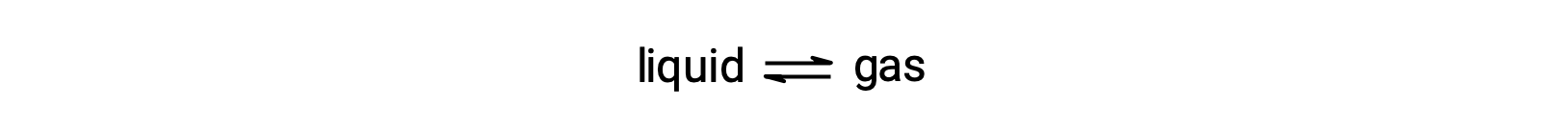
La dissolution d'une substance non volatile dans un liquide volatile entraîne une diminution de la pression de vapeur du liquide. Ce phénomène peut s'expliquer en considérant l'effet des molécules de soluté ajoutées sur les processus de vaporisation et de condensation du liquide. Pour se vaporiser, les molécules de solvant doivent être présentes à la surface de la solution. La présence de soluté diminue la surface dont disposent les molécules de solvant et réduit ainsi la vitesse de vaporisation du solvant. Comme la vitesse de condensation n'est pas influencée par la présence de soluté, le résultat net est que l'équilibre entre la vaporisation et la condensation est atteint avec moins de molécules de solvant dans la phase vapeur (c.-à-d. à une pression de vapeur plus basse).
Bien que cette interprétation soit utile, elle ne tient pas compte de plusieurs aspects importants concernant la nature colligative de la baisse de la pression de vapeur. Une explication plus rigoureuse implique la propriété de l'entropie. Pour comprendre la diminution de la pression de vapeur d'un liquide, il convient de noter que la nature plus dispersée de la matière dans une solution, par rapport aux phases séparées de solvant et de soluté, sert à stabiliser efficacement les molécules de solvant et à gêner leur vaporisation. Une pression de vapeur plus basse se traduit par un point d'ébullition plus élevé.
La relation entre les pressions de vapeur des constituants d'une solution et les concentrations de ces constituants est décrite par la loi de Raoult : la pression partielle exercée par tout constituant d’une solution idéale est égale à la pression de vapeur du constituant pur multipliée par sa fraction molaire dans la solution.
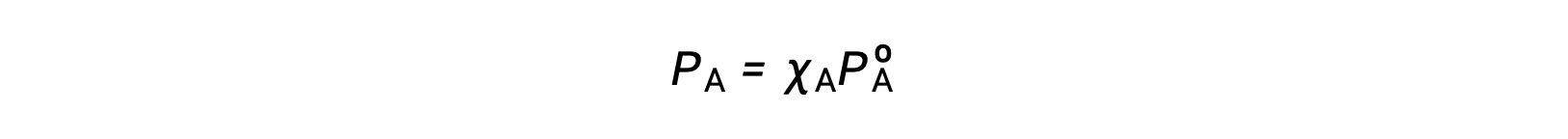
où PA est la pression partielle exercée par le constituant A dans la solution, PºA est la pression de vapeur de A pur, et XA est la fraction molaire de A dans la solution.
Puisque la pression totale d’un mélange gazeux est égale à la somme des pressions partielles de tous ses constituants (loi de Dalton sur les pressions partielles), la pression de vapeur totale exercée par une solution contenant i constituants est
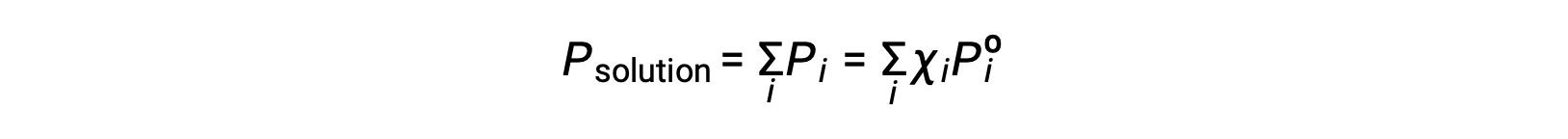
Une substance non volatile est une substance dont la pression de vapeur est négligeable (Pº ≈ 0), et donc la pression de vapeur au-dessus d'une solution contenant uniquement des solutés non volatiles est due uniquement au solvant :
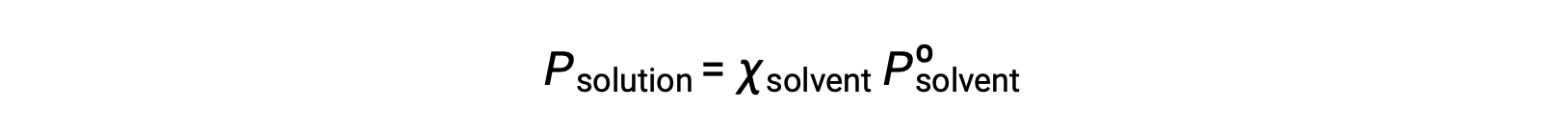
Ce texte est adapté de Openstax, Chimie 2e, Section 11.4 : Propriétés colligatives.


