12.8:
Снижение давления пара
12.8:
Снижение давления пара
Равновесное давление пара жидкости представляет собой давление, оказываемое газообразной фазой при испарении и конденсации при равных скоростях:
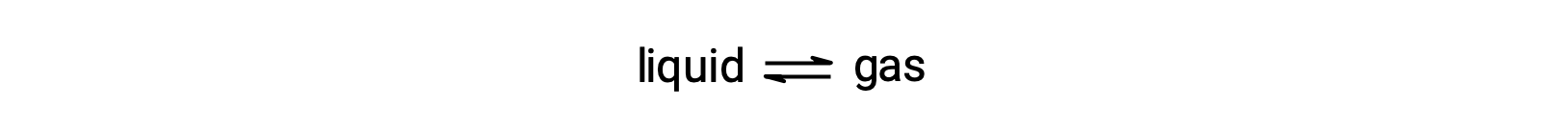
Растворение летучих веществ в летучих жидкостах приводит к снижению давления паров жидкости. Это явление можно объяснить, учитывая влияние добавленных молекул растворённое вещество на процессы испарения и конденсации жидкости. Для испарения на поверхности раствор должны присутствовать молекулы растворителя. Наличие растворённое вещество уменьшает площадь поверхности, доступной для молекул растворителя, и тем самым снижает скорость испарения растворителя. Поскольку на скорость конденсации не влияет наличие растворённое вещество, в результате достигается баланс испарения и конденсации при меньшем количестве молекул растворителя в фазе пара (т.е. при более низком давлении пара).
Хотя такая интерпретация полезна, она не учитывает несколько важных аспектов коллигативной примоль снижения давления пара. Более строгое объяснение связано с свойством энтропии. Для понимания снижения давления паров жидкости достаточно отметить, что более диспергирующий характер вещества в раствор по сравнению с отдельными фазами растворителей и растворённое вещество служит для эффективной стабилизации молекул растворителя и препятствует их испарению. Снижение давления пара приводит к повышению температуры кипения.
Связь между давлением паров компонентов раствор и концентрациями этих компонентов описана в законе Рауля: Парциальное давление, оказываемое любым компонентом идеального раствор, равно давлению паров чистого компонента, умноженному на его долю моль в раствор.
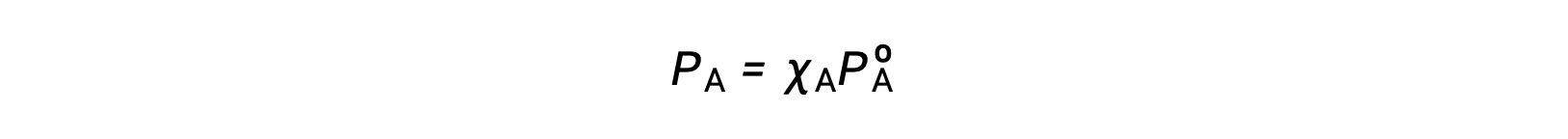
Где PA – это парциальное давление, оказываемое компонентом A в раствор, P?A – это давление пара чистого A, а XA – доля моль в раствор.
Напоминая, что общее давление газовой смеси равно сумме парциального давления для всех ее компонентов (закон Дальтона о парциальном давлении), полное давление паров, оказываемое раствор, содержащим компоненты i.
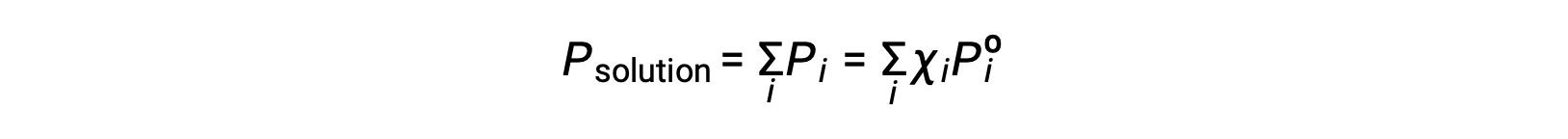
Энергонезависимое вещество – это вещество, давление паров которого составляет пренебрежимый (Po ≈ 0), и поэтому давление паров выше раствор, содержащего только нелетучие соло, вызвано только растворителем:
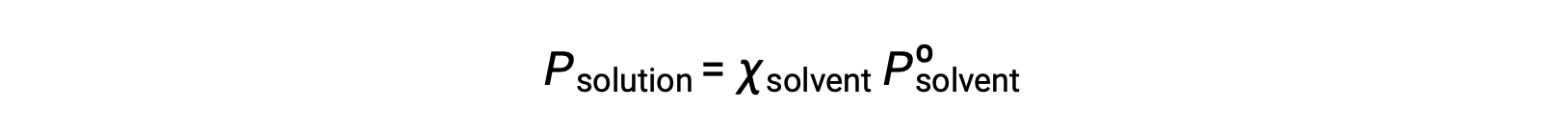
Этот текст адаптирован из Openstax, Химия 2е изд., раздел 11.4:Коллигативные свойства.
Suggested Reading
- Andrews, Frank C. "Colligative properties of simple solutions." Science 194, no. 4265 (1976): 567-571.
- Lindsay Jr, W. T., and Chu Tisin Liu. “Vapor pressure lowering of aqueous solutions at elevated temperatures.” Westinghouse Research Laboratories, Pittsburgh, Pennsylvania, 1968.
- Chinard, Francis P. "Colligative properties." Journal of Chemical Education 32, no. 7 (1955): 377.
