13.1:
Vitesse de réaction
13.1:
Vitesse de réaction
La vitesse de réaction est la variation de la quantité d’un réactif ou d’un produit par unité de temps. Les vitesses de réaction sont donc déterminées en mesurant la dépendance temporelle de certaines propriétés qui peuvent être liées aux quantités de réactifs ou de produits. Les vitesses des réactions qui consomment ou produisent des substances gazeuses, par exemple, sont facilement déterminées en mesurant les changements de volume ou de pression.
La représentation mathématique de la variation de la concentration des réactifs et des produits, au fil du temps, est l’expression de la vitesse de la réaction. Les crochets indiquent des concentrations molaires et le symbole delta (Δ) indique “ variation de ”.
Par exemple, la concentration du peroxyde d’hydrogène, H2O2, dans une solution aqueuse varie lentement au fil du temps, car il se décompose selon l’équation :
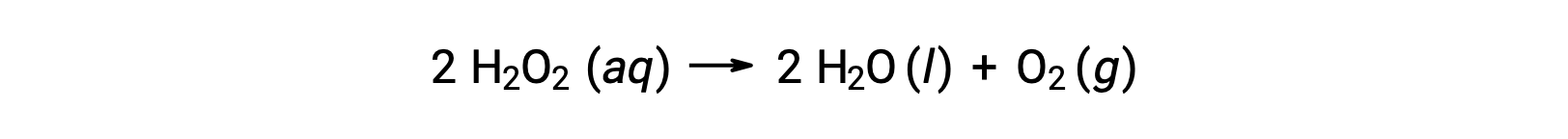
La vitesse à laquelle le peroxyde d’hydrogène se décompose peut être exprimée en termes de vitesse de la variation de sa concentration :

Ainsi, [H2O2]t1 représente la concentration molaire du peroxyde d’hydrogène à l’instant t1 ; de même, [H2O2]t2 représente la concentration molaire du peroxyde d’hydrogène à un instant ultérieur t2 ; et Δ[H2O2] représente la variation de la concentration molaire du peroxyde d’hydrogène pendant l’intervalle de temps Δt (c’est-à-dire t2 − t1). Puisque la concentration en réactifs diminue à mesure que la réaction se poursuit, Δ[H2O2] est une quantité négative. Les vitesses de réaction sont, par convention, des quantités positives, cette variation de concentration négative est donc multiplié par −1.
Vitesse de réaction moyenne et vitesse de réaction instantanée
Les vitesses de réaction varient avec le temps et diminuent au fur et à mesure que la réaction se poursuit. Une vitesse de réaction moyenne sur un intervalle de temps peut être calculée en utilisant les concentrations au début et à la fin de cette période, au cours de laquelle la vitesse de réaction change. À tout moment précis, la vitesse à laquelle une réaction se produit est appelée vitesse instantanée. La vitesse instantanée d’une réaction au “ temps zéro ”, lorsque la réaction débute, est sa vitesse initiale.
La vitesse instantanée d’une réaction peut être déterminée de l’une des deux façons. Si les conditions expérimentales permettent de mesurer les variations de concentration sur de courts intervalles de temps, alors le calcul des vitesses moyennes fournit des approximations raisonnablement bonnes des vitesses instantanées. Sinon, une procédure graphique peut être utilisée. Notamment, dans l’exemple de la décomposition du peroxyde d’hydrogène, en traçant la concentration du peroxyde d’hydrogène en fonction du temps, la vitesse instantanée de décomposition de H2O2 peut être calculée à tout instant ‘ t ’ à partir de la pente d’une tangente à la courbe tracée à cet instant-là.
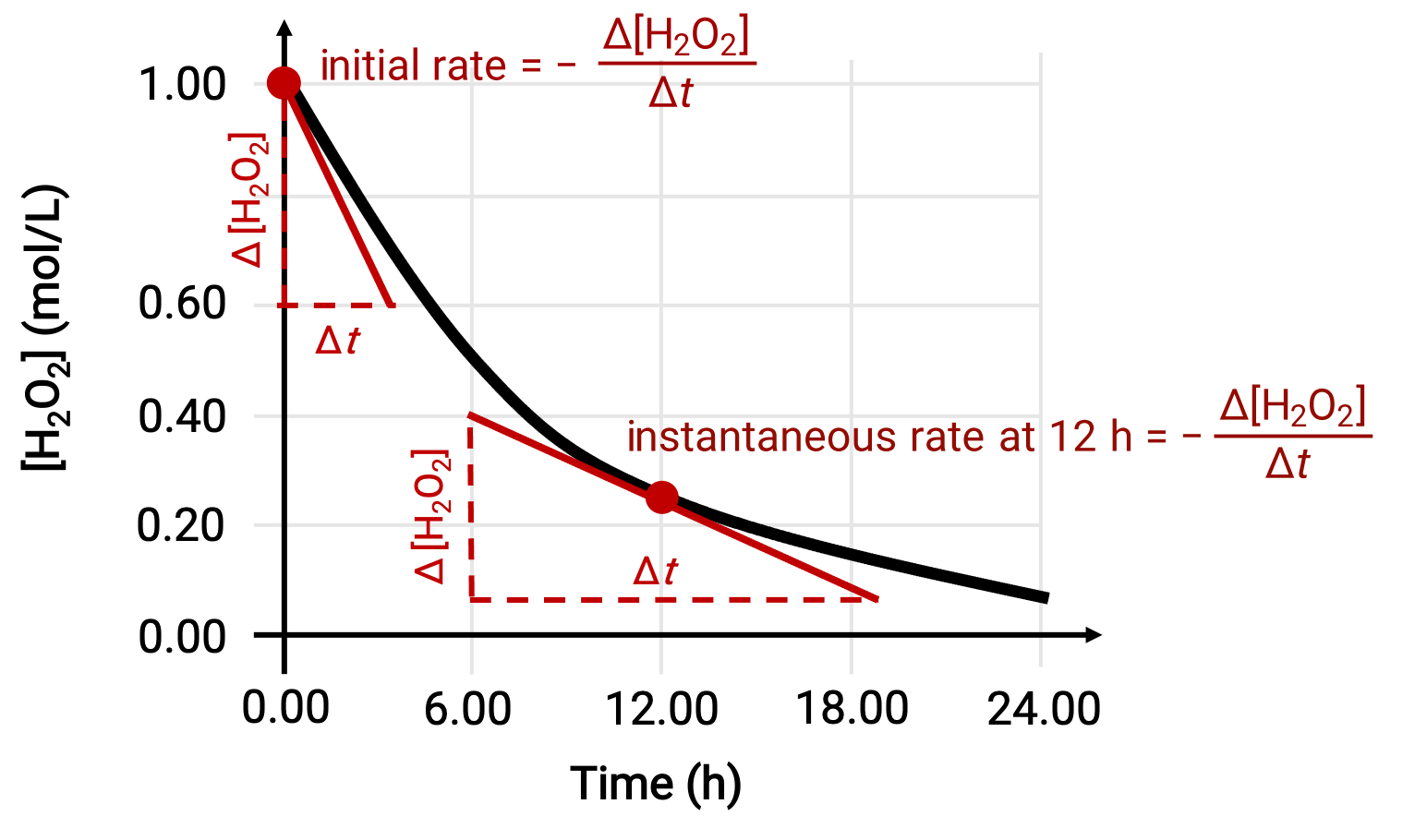
Ce graphique montre un tracé de la concentration par rapport au temps pour une solution de 1,000 M d’H2O2. La vitesse à tout instant est égale à la valeur négative de la pente d’une droite tangente à la courbe à cet instant-là. Les tangentes sont indiquées à t = 0 h (“ vitesse initiale ”) et à t = 12 h (“ vitesse instantanée ” à 12 h).
Vitesses de réaction relatives
La vitesse d’une réaction peut être exprimée comme étant la variation de concentration de tout réactif ou produit. Pour une réaction donnée, ces expressions de la vitesse sont toutes liées les unes aux autres suivant la stœchiométrie de la réaction. La vitesse de la réaction générale aA ⟶ bB peut être exprimée en termes de diminution de la concentration de A ou d’augmentation de la concentration de B. Ces deux expressions de la vitesse sont liées par la stœchiométrie de la réaction, où :
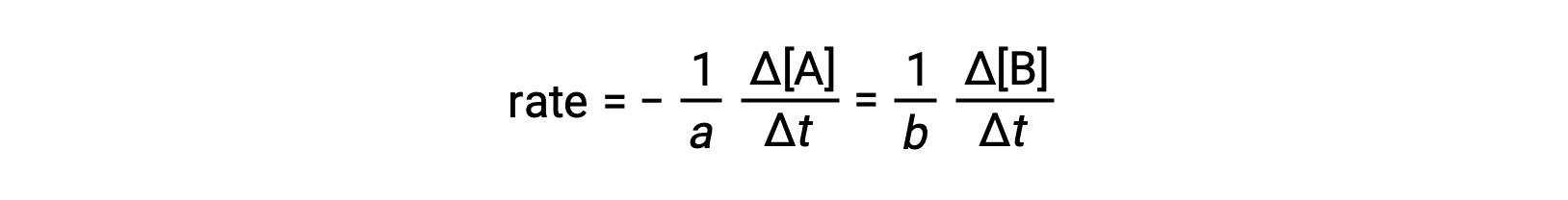
Notez qu’un signe négatif a été inclus comme facteur pour tenir compte des signes opposés des variations des deux quantités (la quantité de réactif diminue alors que la quantité de produit augmente).
Ce texte est adapté de Openstax, Chimie 2e, Chapitre 12 Introduction et Openstax, Chimie 2e, Section 12.1 : Vitesses de réaction chimique.
