13.1:
反応速度
13.1:
反応速度
反応速度とは、単位時間あたりの反応物または生成物の量の変化のことです。したがって、反応速度は、反応物や生成物の量に関係する何らかの特性の時間依存性を測定することによって決定されます。例えば、ガス状の物質を消費したり生成したりする反応の速度は、体積や圧力の変化を測定することで求めることができます。
反応物と生成物の濃度の時間変化を数式で表現したものが反応速度式であり、括弧内はモル濃度、δ( Δ)は “の変化を表します。例えば、水溶液中の過酸化水素(H2O2)の濃度は、次の式に従って分解しながら時間とともにゆっくりと変化します。
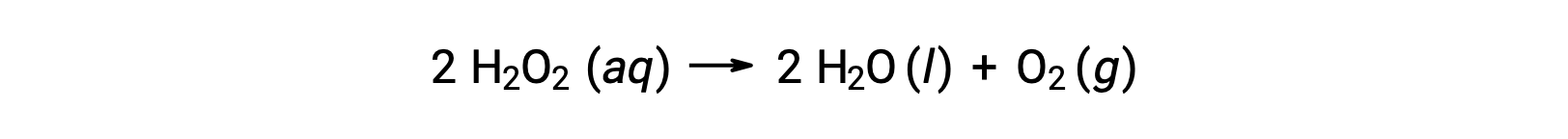
過酸化水素が分解する速度は、その濃度の変化率で表すことができます。

したがって、[H2O2]t1は時間t1での過酸化水素のモル濃度を表します。同様に、[H2O2]t2は後の時間 t2での過酸化水素のモル濃度を表します。Δ [H2O2]は、時間間隔Δt (つまり、t2−t1)中の過酸化水素のモル濃度の変化を表します。反応が進むにつれて反応物の濃度が低下するため、Δ [H2O 2]は負の量になります。反応速度は正の量であるため、この負の濃度変化に− 1を掛けます。
平均反応速度と瞬間反応速度
反応速度は時間とともに変化し、反応が進むにつれて減少します。時間間隔にわたる平均反応速度は、反応速度が変化している間の開始時と終了時の濃度を使用して計算できます。特定の時点における反応進行速度は、瞬間反応速度といいます。 “時間ゼロ”での反応の瞬間速度反応が始まるとき、それは初期反応速度といいます。
瞬間反応速度は、次の2つの方法のいずれかで求めることができます。1つ目として、短い時間間隔での濃度変化測定が可能であるならば、その平均反応速度は瞬間反応速度の良い近似値となります。2つ目として、グラフを用いた方法もあります。例えば、過酸化水素の分解の例では、過酸化水素の濃度を時間に対してプロットすることにより、H2O2分解反応の瞬間速度を、任意の時間 ‘t’にて、曲線の接線の傾きから計算することができます。
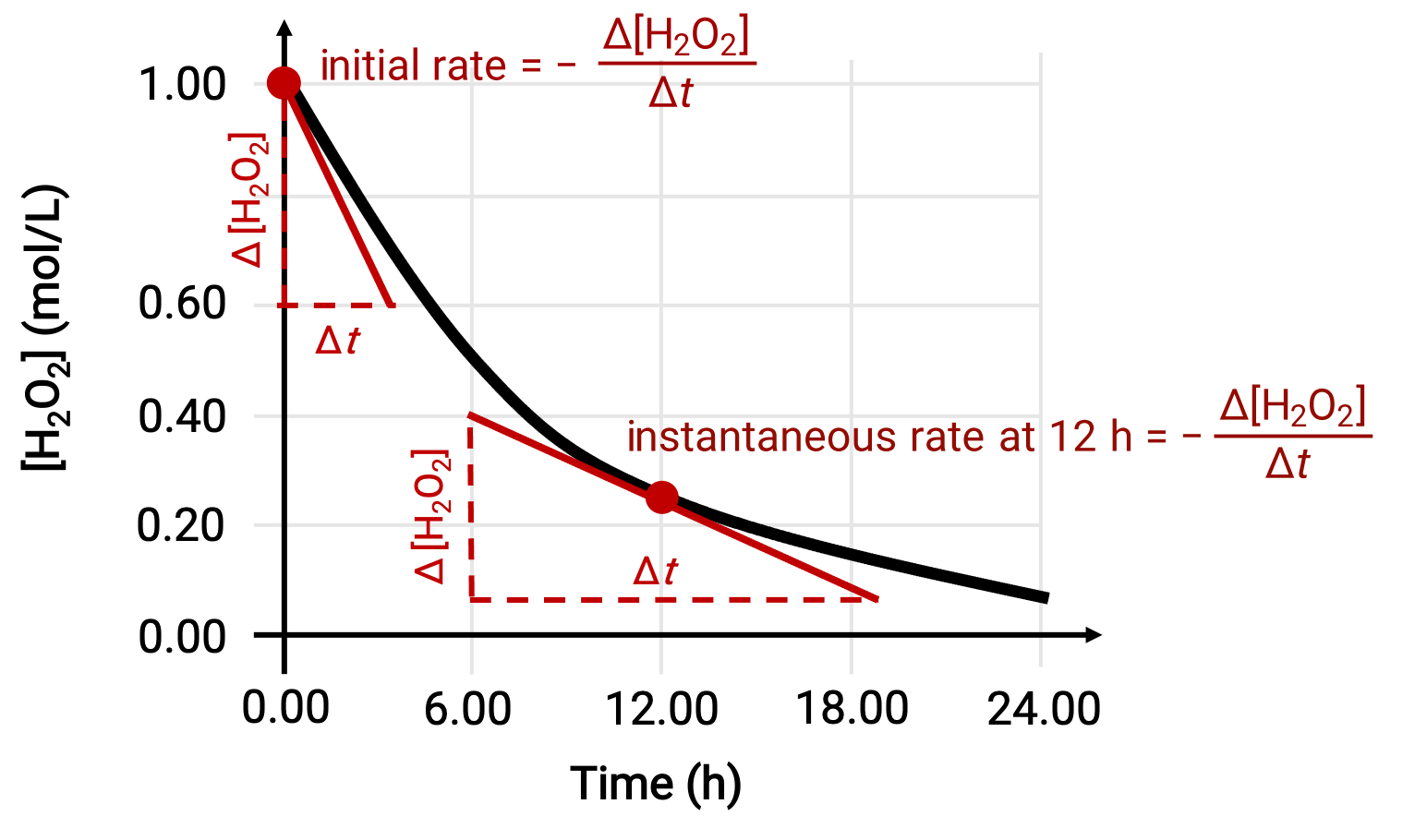
このグラフは、H2O2の1.000 M溶液の濃度と時間の関係を示したものです。任意の時間における速度は、その時間における曲線の接線の傾きの絶対値に等しいです。接線はt = 0時間(“初期速度”)とt = 12時間(“12時間での瞬間速度”)で示されています。
反応の相対速度
反応の速度は、任意の反応物または生成物の濃度の変化として表すことができます。任意の反応について、これらの速度式はすべて反応の化学量論に従って互いに関連しています。一般的な反応であるaA ⟶ bBの反応速度は、Aの濃度の減少またはBの濃度の増加で表すことができます。
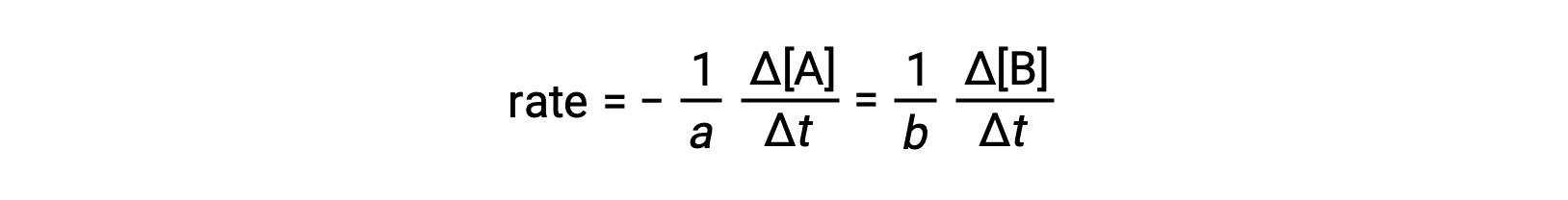
2つの量の変化の符号が逆になっている(反応物の量が減り、生成物の量が増える)ことを考慮して、負の符号を入れていることに注意してください。
上記の文章は以下から引用しました。 Openstax, Chemistry 2e, Chapter 12 Introduction and Openstax, Chemistry 2e, Section 12.1: Chemical Reaction Rates.
