13.1: 反应速率
反应速率是每单位时间反应物或生成物的数量的变化。 因此,可以通过测量与反应物或生成物金额相关的某些属性的时间依赖性来确定反应率。 例如,消耗或产生气体物质的反应速率是通过测量体积或压力的变化而方便地确定的。
随着时间的推移,反应物和产品浓度变化的数学表示是反应的速率表达。 括号表示摩尔浓度,符号 delta (Δ) 表示“中的变化”。
例如,水溶液中的过氧化氢 H2O2 浓度随着时间的推移而缓慢变化,因为它会根据方程分解:
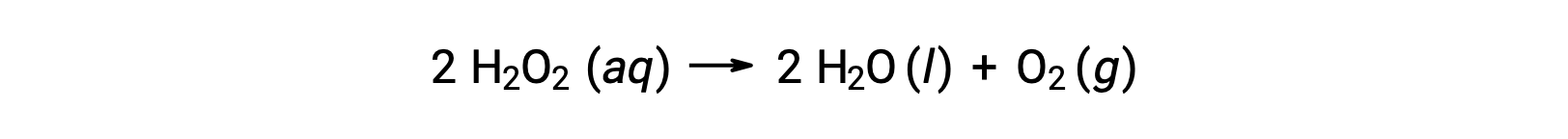
过氧化氢分解的速度可以用其浓度的变化速率来表示:

因此, [H2O2]T1表示时间 T1 时过氧化氢的摩尔浓度;同样, [H2O2]T2 表示以后过氧化氢的摩尔浓度 T2 ;而 Δ [H2O2] 表示时间间隔 Δt (即 T2 − T1) 期间过氧化氢的摩尔浓度的变化。 由于反应物浓度随着反应的进行而下降, Δ [H2O2] 是一个负量。 按照惯例,反应率为正量,因此浓度的这一负变化乘以 −1。
平均反应速度和瞬时反应速度
反应速度随时间的变化而变化,随着反应的进行而下降。 一段时间间隔内的平均反应速率可使用该时段开始和结束时的浓度计算,在此期间内,反应速率将发生变化。 在任何特定时间,反应的进行速率都称为瞬间速率。 反应开始时“时间零”时的瞬间反应速率是其初始速率。
反应的瞬时速率可以通过两种方法之一来确定。 如果实验条件允许在短时间间隔内测量浓度变化,则平均率的计算提供了相当好的瞬时率近似值。 或者,可以使用图形化过程。 例如,在过氧化氢分解示例中,通过绘制过氧化氢浓度与时间的对比图,可以随时从当时绘制到曲线的相切斜率 ‘t ’计算出 H2O2 的瞬时分解率。
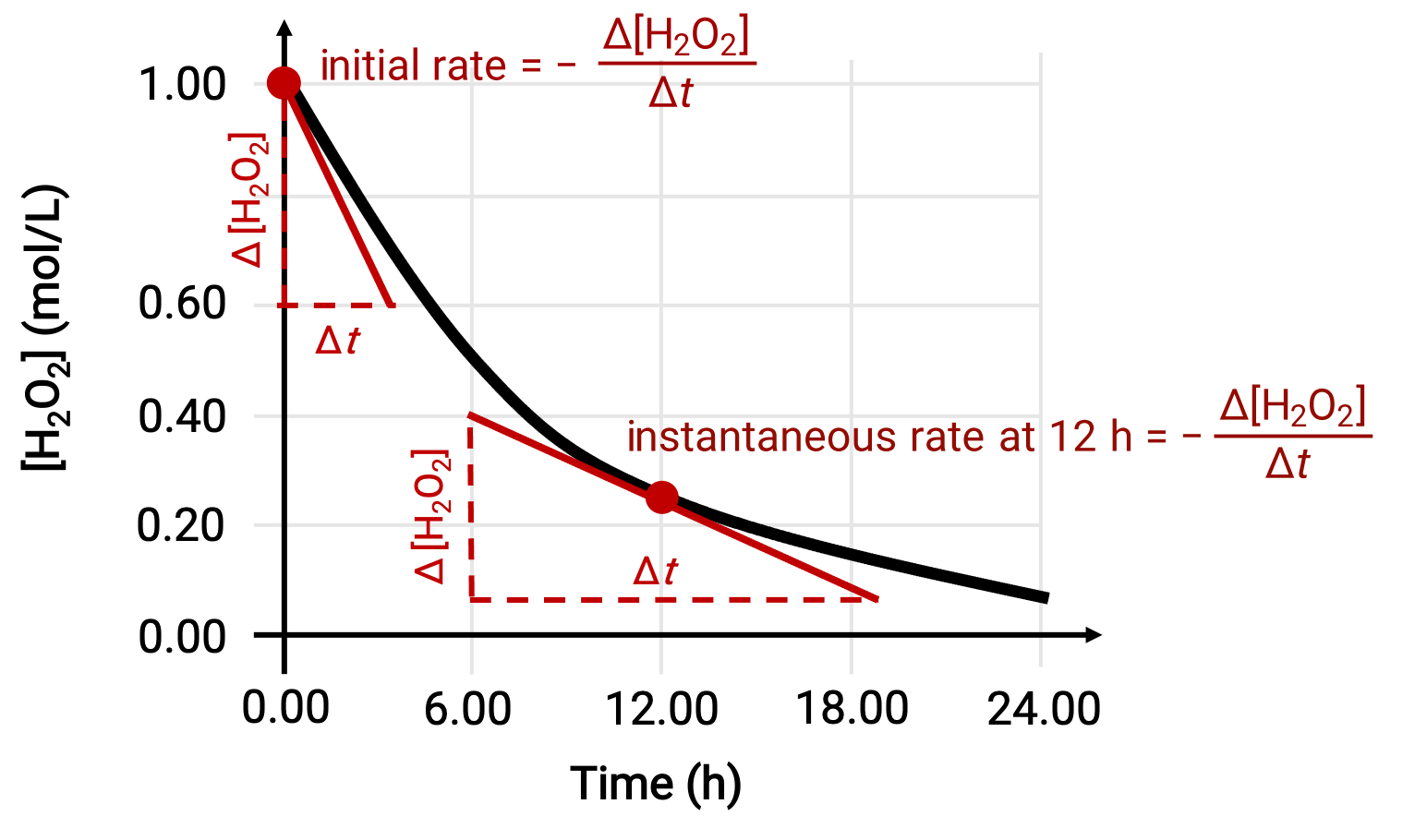
此图显示了 1000 M 溶液 H2O2 的浓度与时间的图解。 任何时候的速率都等于该时间与曲线相切的直线斜率的负值。 切面显示为 t = 0 h (“初始速率”) , t = 12 h (“瞬时速率”为 12 h)。
相对反应速率
反应速率可表示为任何反应物或生成物浓度的变化。 对于任何给定的反应,根据反应化学计量法,这些速率表达式都相互关联。 一般反应 AA ⟶ BB 的速率可以用 A 浓度的下降或 B 浓度的增加来表示。 这两种速率表达与反应的化学计量有关,其中:
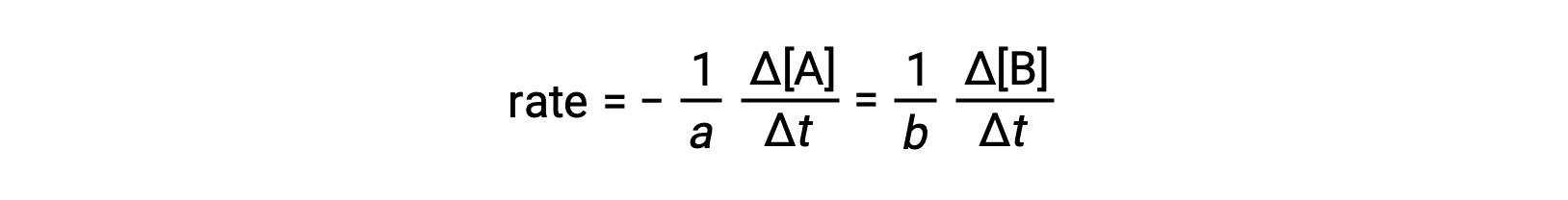
请注意, 已包含负号作为说明两个量变化的相反符号的因素(当生成物数量增加时,反应物数量下降)。
本文改编自 Openstax, 化学 2e, 第12章: 简介 和 Openstax, 化学 2e, 第12.1节:化学反应速率。


