13.1:
Velocità di reazione
13.1:
Velocità di reazione
La velocità di reazione è la variazione della quantità di un reagente o prodotto per unità di tempo. I tassi di reazione sono quindi determinati misurando la dipendenza dal tempo di alcune proprietà che possono essere correlate a quantità reagenti o di prodotto. I tassi di reazioni che consumano o producono sostanze gassose, ad esempio, sono convenientemente determinati misurando le variazioni di volume o pressione.
La rappresentazione matematica del cambiamento nella concentrazione di reagenti e prodotti, nel tempo, è l’espressione di velocità per la reazione. Le parentesi indicano concentrazioni molare e il simbolo delta (Δ) indica “cambiamento in”.
Ad esempio, la concentrazione di perossido di idrogeno, H2O 2 , in unasoluzioneacquosa cambia lentamente nel tempo mentre si decompone secondo l’equazione:
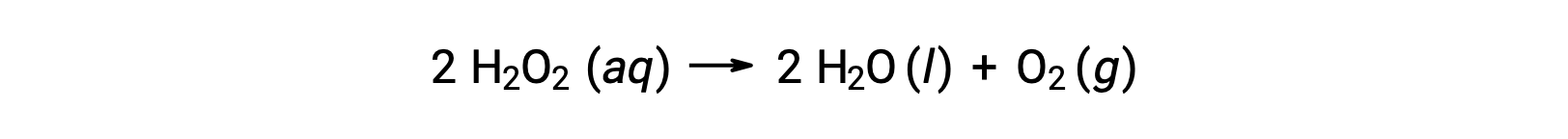
La velocità con cui il perossido di idrogeno si decompone può essere espressa in termini di tasso di variazione della sua concentrazione:

Pertanto, [H2O2]t1 rappresenta la concentrazione molare di perossido di idrogeno al tempo t1; allo stesso modo, [H2O2]t2 rappresenta la concentrazione molare di perossido di idrogeno in un secondo momento t2; e Δ[H2O2] rappresenta il cambiamento nella concentrazione molare del perossido di idrogeno durante l’intervallo di tempo Δt (cioè t2 − t1). Poiché la concentrazione del reagente diminuisce man mano che la reazione procede, Δ[H2O2] è una quantità negativa. I tassi di reazione sono, per convenzione, quantità positive, e quindi questo cambiamento negativo di concentrazione è moltiplicato per −1.
Velocità di reazione media e velocità di reazione istantanea
I tassi di reazione variano con il tempo e diminuiscono man mano che la reazione procede. Una velocità di reazione media su un intervallo di tempo può essere calcolata utilizzando le concentrazioni all’inizio e alla fine di questo periodo, durante le quali la velocità di reazione sta cambiando. In qualsiasi momento specifico, la velocità con cui una reazione sta procedendo è nota come velocità istantanea. La velocità istantanea di una reazione al “tempo zero”, quando inizia la reazione, è la sua velocità iniziale.
La velocità istantanea di una reazione può essere determinata da uno dei due modi. Se le condizioni sperimentali consentono la misurazione delle variazioni di concentrazione su brevi intervalli di tempo, allora il calcolo dei tassi medi fornisce approssimazioni ragionevolmente buone dei tassi istantanei. In alternativa, può essere utilizzata una procedura grafica. Per esempio, nell’esempio di decomposizione del perossido di idrogeno, tracciando la concentrazione di perossido di idrogeno rispetto al tempo, la velocità istantanea di decomposizione di H2O2 può essere calcolata in qualsiasi momento ‘t‘ dalla pendenza di una tangente disegnata alla curva in quel momento.
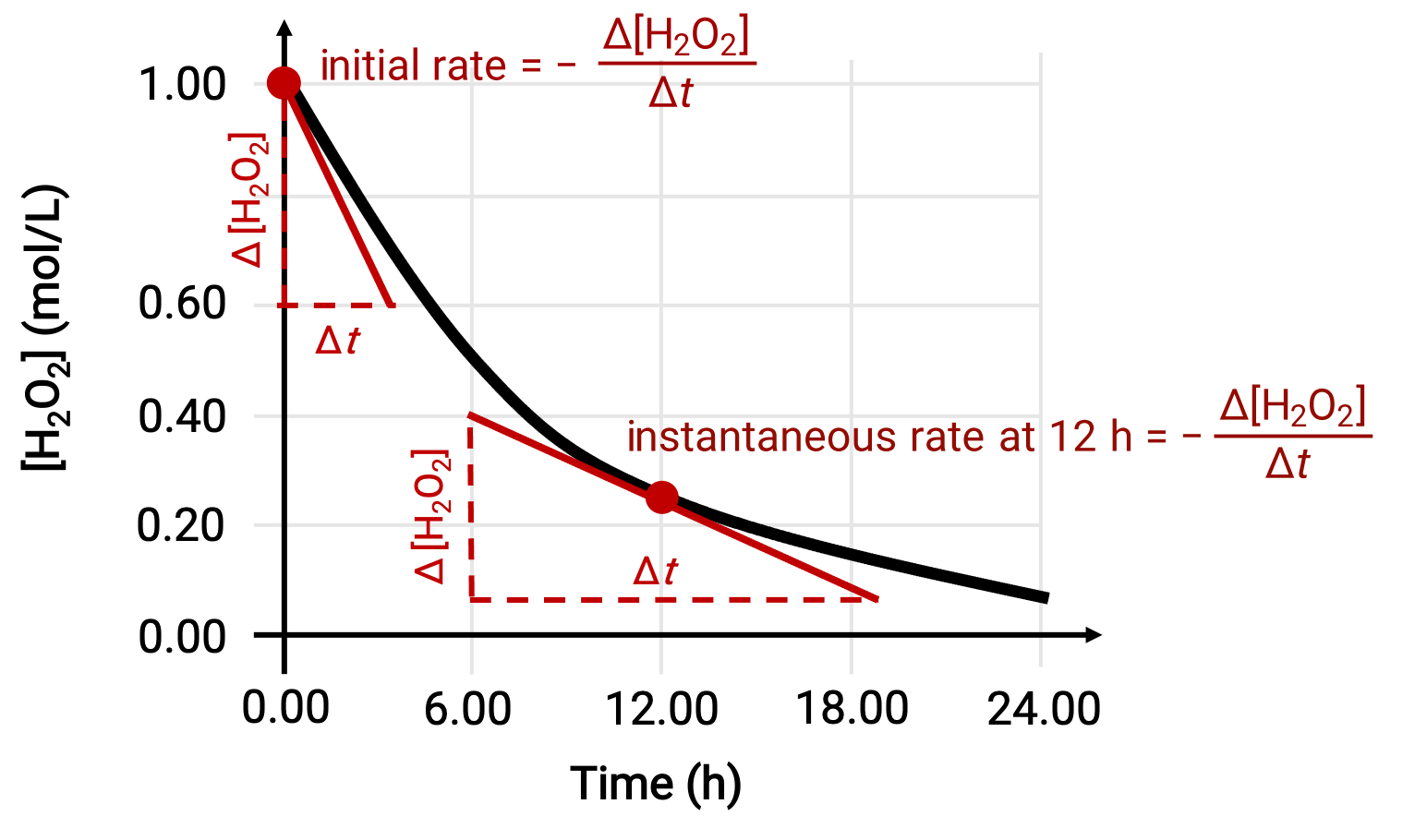
Questo grafico mostra un grafico di concentrazione rispetto al tempo per una soluzione di 1.000 M di H2O2. La velocità in qualsiasi momento è uguale al negativo della pendenza di una linea tangente alla curva in quel momento. Le tangenti sono mostrate a t = 0 h (“tasso iniziale”) e a t = 12 h (“velocità istantanea” a 12 h).
Tassi di reazione relativi
Il tasso di reazione può essere espresso come variazione di concentrazione di qualsiasi reagente o prodotto. Per ogni data reazione, queste espressioni di velocità sono tutte correlate l’una all’altra in base alla stechiometria di reazione. Il tasso della reazione generale aA ⟶ bB può essere espresso in termini di diminuzione della concentrazione di A o di aumento della concentrazione di B. Queste due espressioni di velocità sono correlate dalla stechiometria della reazione, dove:
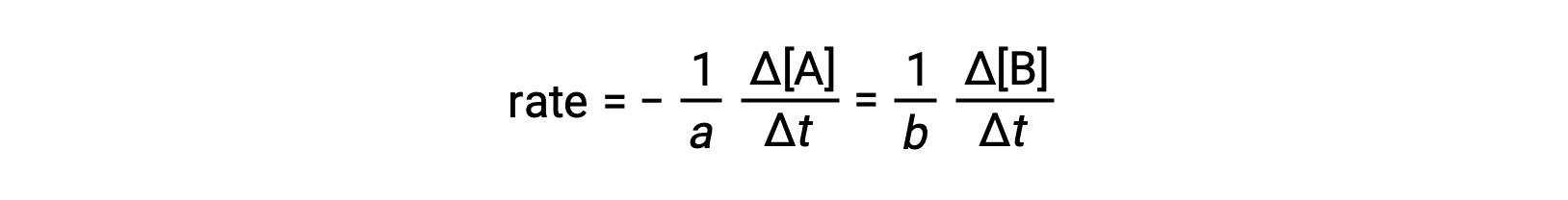
Si noti che un segno negativo è stato incluso come fattore per tenere conto dei segni opposti delle due variazioni di quantità (la quantità di reagente sta diminuendo mentre la quantità del prodotto è in aumento).
Questo testo è adattato da Openstax, Chimica 2e, Capitolo 12 Introduzione e Openstax, Chimica 2e, Sezione 12.1: Tassi di reazione chimica.
