13.1:
반응 속도
13.1:
반응 속도
반응 속도는 단위 시간당 반응제 또는 제품의 양이 변화합니다. 따라서 반응 속도는 반응제 또는 제품 양과 관련될 수 있는 일부 특성의 시간 의존성을 측정하여 결정됩니다. 예를 들어, 기체 물질을 소비하거나 생산하는 반응의 비율은 부피 또는 압력의 변화를 측정하여 편리하게 결정됩니다.
반응물질 및 제품의 농도 변화에 대한 수학적 표현은 시간이 지남에 따라 반응에 대한 속도 표현이다. 괄호는 어금니 농도를 나타내고 심볼 델타(Δ)는 “변경”을 나타냅니다.
예를 들어, 과산화수소의 농도, H2O2,수성 용액에서 방정식에 따라 분해됨에 따라 시간이 지남에 따라 천천히 변경됩니다.
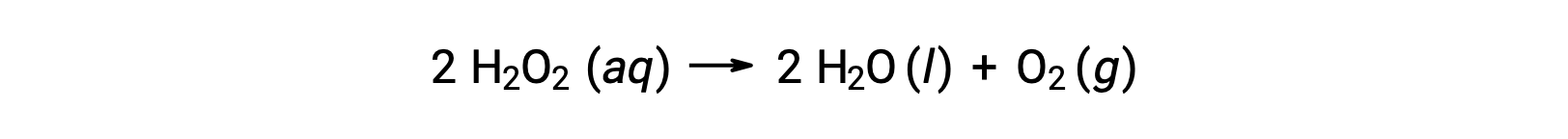
과산화수소분해속도는 농도의 변화율측면에서 발현될 수 있다.

따라서[H2O2]t1은 t1시에과산화수소의 어금니 농도를 나타낸다. 마찬가지로,[H2O2]t2는 나중에 과산화수소의 어금니 농도를 나타내며 t2; 및 Δ[H 2 O2]는시간 간격 Δt 동안 과산화수소의 어금니 농도의 변화를 나타낸다 (즉, t2 – t1). 반응이 진행됨에 따라 반응 농도가 감소하기 때문에 Δ[H2O2]는음수입니다. 반응 속도는, 규칙에 의해, 긍정적 인 양, 그래서 농도의 이 부정적인 변화는 -1곱됩니다.
평균 반응 속도 및 즉각적인 반응 속도
반응 속도는 반응이 진행됨에 따라 시간과 감소에 따라 다릅니다. 시간 간격에 걸쳐 평균 반응 속도는 반응 속도가 변화하는이 기간의 시작과 끝에 농도를 사용하여 계산 될 수있다. 어떤 특정 시간에, 반응이 진행되는 속도는 그것의 즉각적인 비율로 알려져 있습니다. 반응이 시작될 때 “시간 제로”에서 반응의 즉각적인 속도는 초기 속도입니다.
반응의 즉각적인 속도는 두 가지 방법 중 하나에 의해 결정될 수 있다. 실험 조건이 짧은 시간 간격에 걸쳐 농도 변화를 측정할 수 있도록 허용하는 경우 평균 속도계산은 즉각적인 속도의 합리적으로 양호한 근사치를 제공합니다. 또는 그래픽 프로시저를 사용할 수 있습니다. 예를 들어, 과산화수소 분해 예에서는, 시간에 대한 과산화수소의 농도를 플로팅함으로써,H2 O2의분해의 즉각적인 분해 속도는 그 때 곡선에 그려진 접선의 경사로부터 언제든지‘t’를계산할 수 있다.
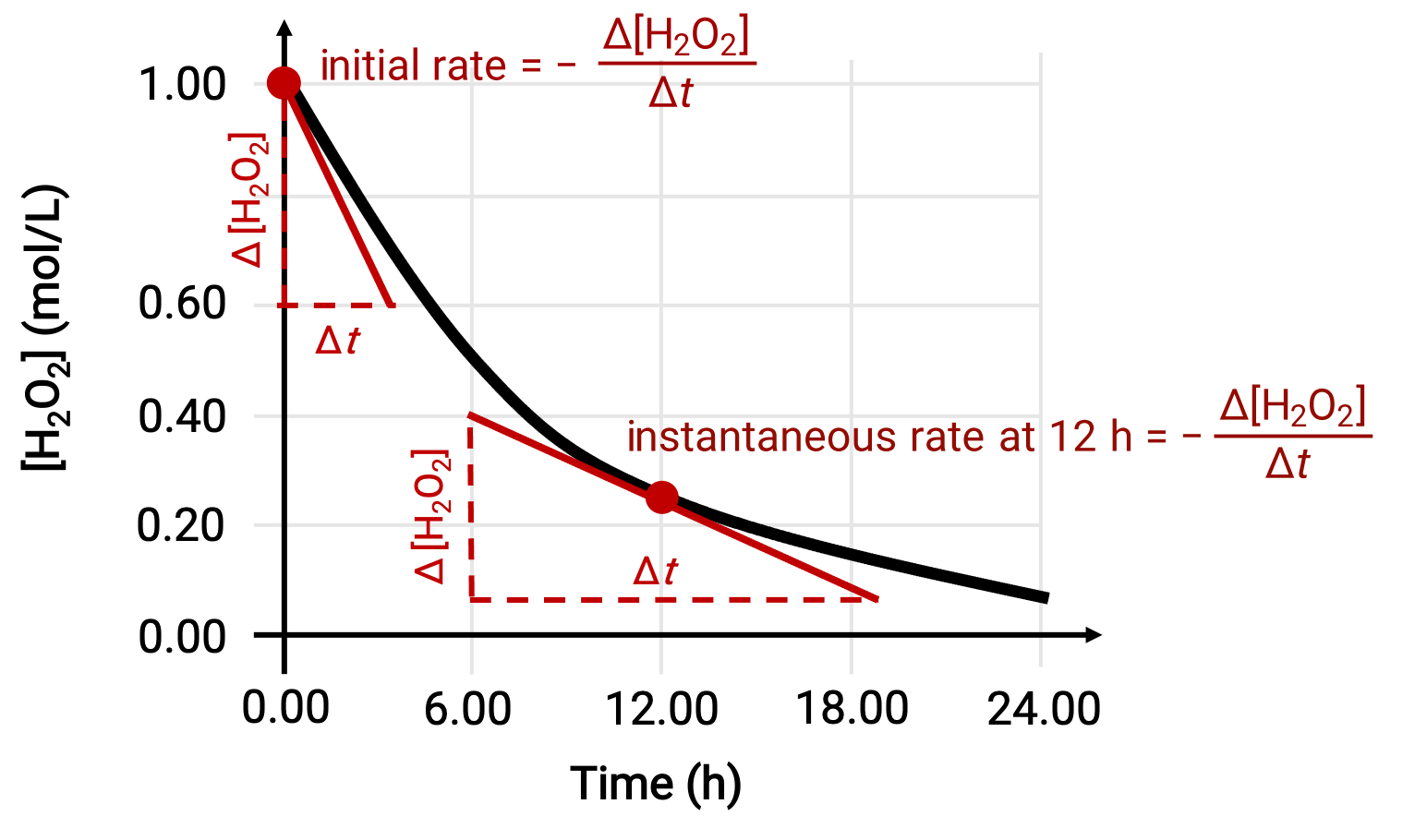
이 그래프는 H 2O2의1.000 M 솔루션에 대한 농도 대 시간 플롯을 보여줍니다. 언제든지 속도는 해당 시간에 곡선에 접선선의 기울기의 음수와 같습니다. 접선은 t = 0h (“초기 속도”) 및 t = 12 h (12 h에서 “즉각적인 속도”)로 표시됩니다.
상대반응비율
반응의 속도는 임의의 반응또는 제품의 농도의 변화로 표현될 수 있다. 주어진 반응에 대해, 이러한 속도 표현은 모두 반응 stoichiometry에 따라 서로 관련이 있습니다. 일반적인 반응의속도 A∞ b B는A의 농도감소 또는 B의 농도 증가 측면에서 발현될 수 있다. 이 두 속도 표현은 반응의 stoichiometry에 의해 관련됩니다, 여기서:
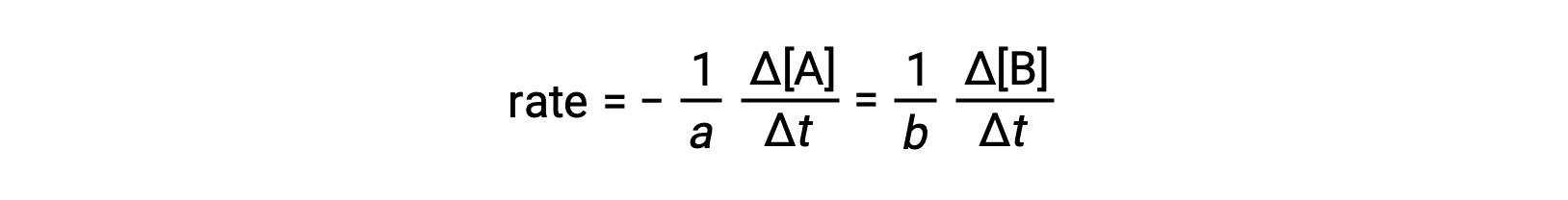
음수 기호는 두 가지 양 변경의 반대 징후를 설명하는 요인으로 포함되었습니다 (제품 양이 증가하는 동안 반응량은 감소합니다).
이 텍스트는 Openstax, Chemistry 2e, 12장 소개 및 오픈탁스, 화학 2e, 섹션 12.1: 화학 반응 비율에서 채택됩니다.
