13.5:
A Lei da Velocidade Integrada: A Dependência da Concentração em Relação ao Tempo
13.5:
A Lei da Velocidade Integrada: A Dependência da Concentração em Relação ao Tempo
Enquanto que a lei de velocidade diferencial relaciona a velocidade e as concentrações de reagentes, uma segunda forma de lei de velocidade chamada lei de velocidade integrada relaciona concentrações de reagentes e tempo. As leis de velocidades integradas podem ser usadas para determinar a quantidade de reagentes ou produtos presentes após um período de tempo ou para estimar o tempo necessário para que uma reação prossiga até certo ponto. Por exemplo, uma lei de velocidade integrada ajuda a determinar o período de tempo durante o qual uma matéria radioativa deve ser armazenada para que a sua radioatividade decaia para um nível seguro.
Usando cálculo, a lei da velocidade diferencial para uma reação química pode ser integrada em relação ao tempo para dar uma equação que relaciona a quantidade de reagente/produto ao tempo decorrido da reação.
Reações de Primeira Ordem
A integração da lei de velocidade para uma reação simples de primeira ordem (velocidade = k[A]) resulta em uma equação que descreve a variação da concentração de reagentes com o tempo:
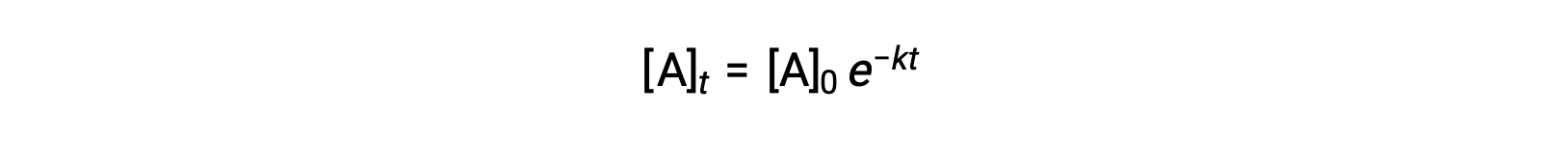
Aqui, [A]t é a concentração de A a qualquer momento t, [A]0 é a concentração inicial de A, e k é a constante de velocidade de primeira ordem. Para conveniência matemática, esta equação é rearranjada para um formato que mostra uma dependência linear da concentração no tempo que assume a forma de uma equação de linha recta (y = mx + b): :
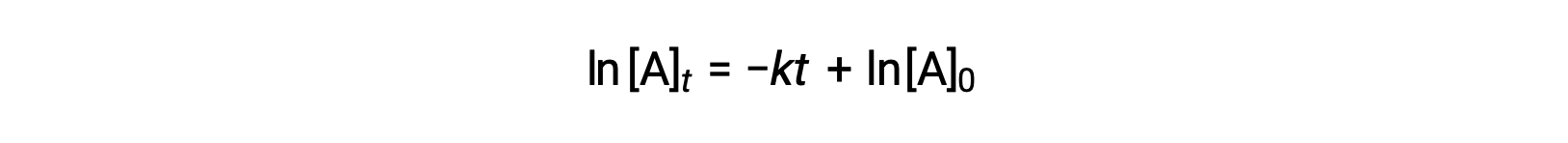
A equação sugere que um gráfico de ln[A]t versus t para uma reação de primeira ordem é uma linha recta com um declive de −k e uma intercepção y de ln[A]0. Se um conjunto de dados de velocidade for representado desta forma, mas não resultar em uma linha recta, a reação não é de primeira ordem em A.
Reações de Segunda Ordem
A lei de velocidade diferencial para uma reação simples de segunda ordem é velocidade = k[A]2, e a lei de velocidade integrada é:
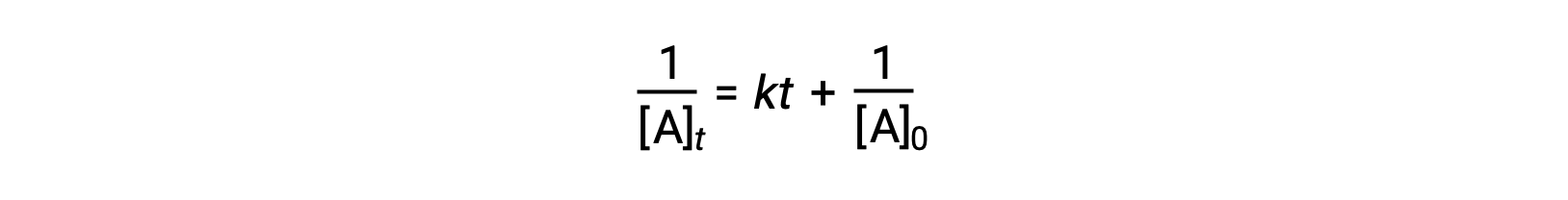
A lei de velocidade integrada de segunda ordem também assume a forma da equação para uma linha recta. De acordo com a equação, um gráfico de 1/[A]t versus t para uma reação de segunda ordem é uma linha recta com um declive de e uma intercepção y de 1/[A]0. Se o gráfico não for uma linha recta, então a reação não é de segunda ordem.
Reações de Ordem Zero
Para reações de ordem zero, a lei de velocidade diferencial é velocidade = k. Uma reação de ordem zero apresenta uma velocidade de reação constante, independentemente da concentração do(s) seu(s) reagente(s). A cinética de ordem zero é observada para algumas reações apenas em determinadas condições específicas. Essas mesmas reações apresentam diferentes comportamentos cinéticos quando as condições específicas não são atendidas e, por isso, o termo pseudo-ordem zero mais prudente é às vezes usado.
A lei de velocidade integrada para uma reação de ordem zero é também uma função linear, sob a forma de y = mx + b:
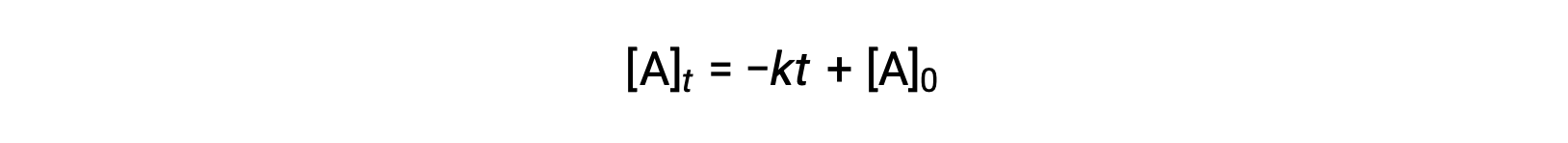
Um gráfico de [A] versus tempo t para uma reação de ordem zero é uma linha recta com um declive de −k e uma intercepção y de [A]0.
Este texto é adaptado de Openstax, Chemistry 2e, Section 12.4: Integrated Rate Laws.
