13.5:
قانون المعدّل المتكامل: اعتماد التركيز على الوقت
13.5:
قانون المعدّل المتكامل: اعتماد التركيز على الوقت
بينما يتعلق قانون المعدل التفاضلي بمعدل وتركيزات المواد المتفاعلة، فإن الشكل الثاني من قانون المعدل المسمّى قانون المعدل المتكامل يتعلق بتركيزات المواد المتفاعلة والوقت. يمكن استخدام قوانين المعدل المتكامل لتحديد كمية المادة المتفاعلة أو المنتج الموجود بعد فترة زمنية أو لتقدير الوقت اللازم لحدوث رد فعل ما إلى حد معين. على سبيل المثال ، يساعد قانون المعدل المتكامل في تحديد المدة الزمنية التي يجب تخزين المادة المشعة فيها حتى يتحلل نشاطها الإشعاعي إلى مستوى آمن.
باستخدام حساب التفاضل والتكامل ، يمكن دمج قانون المعدل التفاضلي لتفاعل كيميائي فيما يتعلق بالوقت لإعطاء معادلة تتعلق بكمية المادة المتفاعلة / المنتج بالوقت المنقضي للتفاعل.
ردود الفعل من الدرجة الأولى
ينتج عن تكامل قانون المعدل لتفاعل بسيط من الدرجة الأولى (المعدّل = k[A]) معادلة تصف التباين في تركيز المادة المتفاعلة مع الوقت:
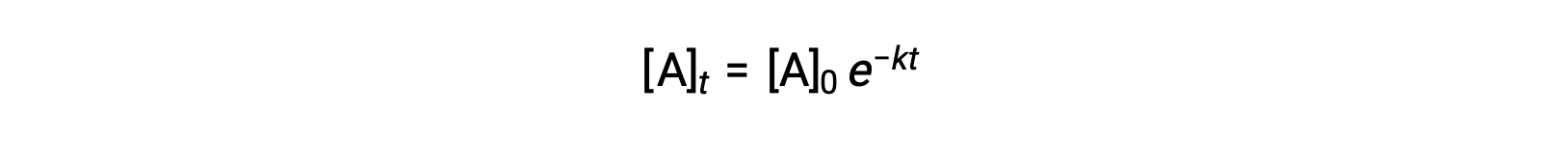
هنا، [A] t هو تركيز A في أي وقت t، ويكون [A]0 هو التركيز الأولي لـ A، و k هو ثابت معدل الدرجة الأولى. لتسهيل العمليات الحسابية، تمت إعادة ترتيب هذه المعادلة إلى تنسيق يوضح اعتماداً خطياً للتركيز على الوقت الذي يأخذ شكل معادلة خط مستقيم (y = mx + b):
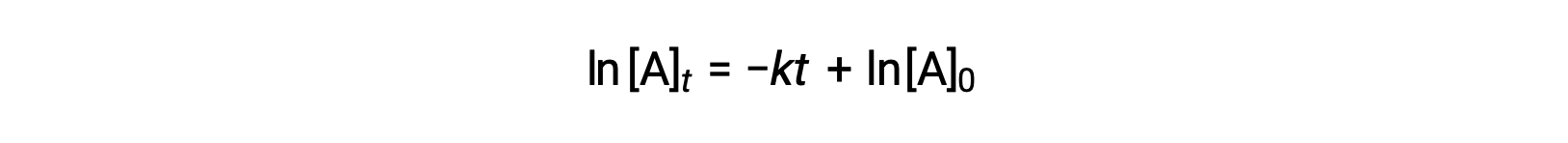
تقترح المعادلة أن مخطط ln[A]t مقابل t بالنسبة إلى تفاعل من الدرجة الأولى هو خط مستقيم بميل −k and a y-مَيل من ln[A]0. إذا تم رسم مجموعة من بيانات المعدلات بهذه الطريقة ولم ينتج عنها خط مستقيم، فإن التفاعل ليس من الدرجة الأولى في A.
التفلاعلات من الدرجة الثانية
قانون المعدل التفاضلي لتفاعل بسيط من الدرجة الثانية هو: المعدّل = k[A]2, وقانون المعدّل المتكامل هو:
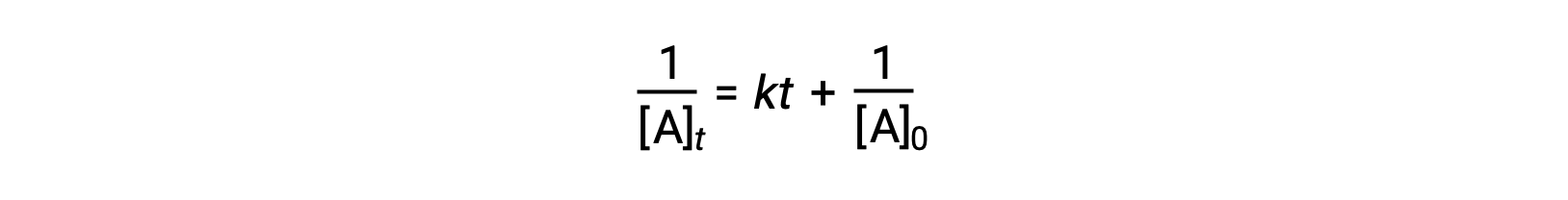
يأخذ قانون المعدل المتكامل من الدرجة الثانية أيضًا شكل معادلة الخط المستقيم. وفقًا للمعادلة ، فإن الرسم البياني 1/[A]t مقابل t للتفاعل من الدرجة الثانية هو خط مستقيم بمَيل k وتقاطع 1/[A]0. إذا لم يكن المخطط خطاً مستقيماً، فإن التفاعل ليس من الدرجة الثانية.
ترتيب صفري Reactions
بالنسبة للتفاعلات الصفرية، يكون قانون المعدل التفاضلي هو: المعدّل = k. A يُظهر التفاعل الصفري معدل تفاعل ثابتًا، بغض النظر عن تركيز المادة (المواد) المتفاعلة. لوحظت حركيات الترتيب الصفري لبعض التفاعلات فقط في ظل ظروف معينة محددة. تظهر هذه التفاعلات نفسها سلوكيات حركية مختلفة عندما لا’ تتحقق الشروط المحددة ، ولهذا السبب ، يتم استخدام المصطلح الأكثر حكمة أحيانًا الترتيب شبه الصفري.
قانون المعدل المتكامل للتفاعل الصفري هو أيضًا دالة خطية ، تتخذ شكل y = mx + b:
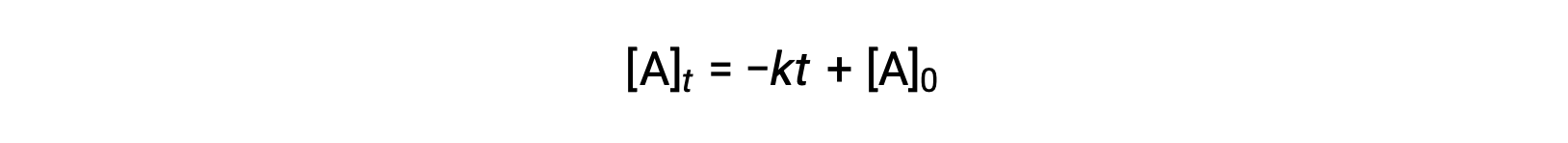
مخطط [A] مقابل الوقت t للتفاعل الصفري هو خط مستقيم بميل −k و y-تقاطع [A]0.
هذا النص مقتبس من Openstax, Chemistry 2e, Section 12.4: Integrated Rate Laws.
