13.5:
Entegre Oran Yasası: Konsantrasyonun Zamana Bağımlılığı
13.5:
Entegre Oran Yasası: Konsantrasyonun Zamana Bağımlılığı
Diferansiyel hız kanunu, reaktanların oranını ve konsantrasyonlarını ilişkilendirirken, entegre hız kanunu adı verilen ikinci bir hız kanunu formu, reaktanların konsantrasyonları ve zamanı ilişkilendirir. Bir süre sonra mevcut olan reaktan veya ürünün miktarını belirlemek veya bir reaksiyonun belirli bir dereceye kadar ilerlemesi için gereken süreyi tahmin etmek için entegre hız yasaları kullanılabilir. Örneğin, entegre bir hız yasası, radyoaktivitesinin güvenli bir seviyeye düşmesi için bir radyoaktif malzemenin ne kadar süreyle depolanması gerektiğini belirlemeye yardımcı olur.
Analiz kullanılarak, bir kimyasal reaksiyon için diferansiyel oran yasası, reaksiyonun geçen süresi ile reaktan / ürün miktarını ilişkilendiren bir denklem vermek için zamana göre entegre edilebilir.
Birinci derece reaksiyonlar
Basit bir birinci dereceden reaksiyon için hız yasasının entegrasyonu (oran = k[A]), reaktan konsantrasyonunun zamanla değişimini açıklayan bir denklemle sonuçlanır:
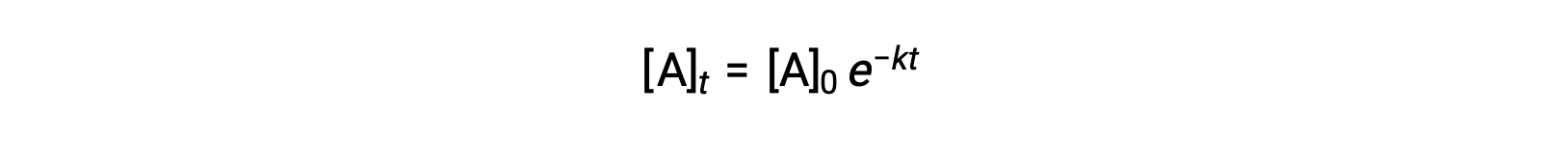
Burada, [A]t, herhangi bir t anındaki A konsantrasyonudur, [A]0, A’nın başlangıç konsantrasyonudur ve k, birinci dereceden hız sabitidir. Matematiksel kolaylık için, bu denklem, düz çizgi denklemi şeklini alan, zamana doğrusal bir konsantrasyon bağımlılığını gösteren bir biçime yeniden düzenlenmiştir (y = mx + b):
Burada, [A]t, herhangi bir t anındaki A konsantrasyonudur, [A]0, A’nın başlangıç konsantrasyonudur ve k, birinci dereceden hız sabitidir. Matematiksel kolaylık için, bu denklem, düz çizgi denklemi şeklini alan, zamana doğrusal bir konsantrasyon bağımlılığını gösteren bir biçime yeniden düzenlenmiştir: 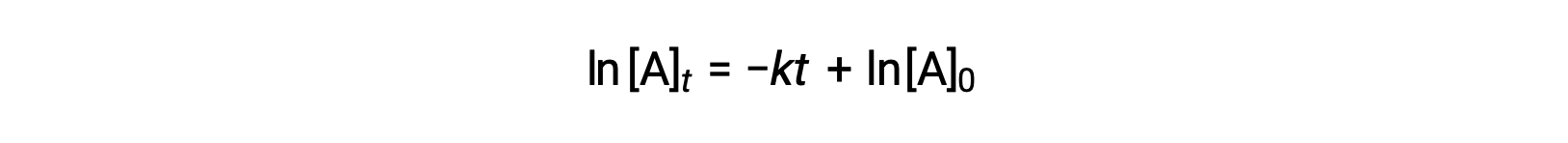
Denklem, birinci dereceden bir reaksiyon için ln[A]t‘ye karşı t‘nin bir grafiğinin, −k eğimi ve ln[A]0‘ın y kesişimi olan düz bir çizgi olduğunu öne sürüyor. Bir dizi hız verisi bu şekilde çizilirse ancak düz bir çizgiyle sonuçlanmazsa, reaksiyon A‘da birinci derece değildir.
İkinci Derece Reaksiyonlar
Basit bir ikinci dereceden reaksiyon için diferansiyel oran yasası, oran = k[A]2 , ve entegre oran yasası:
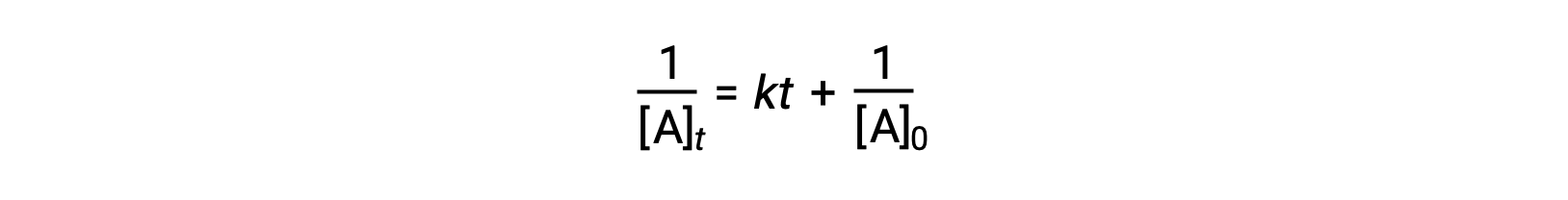
İkinci dereceden entegre oran yasası ayrıca düz bir çizgi için denklem biçimini alır. Denkleme göre, ikinci dereceden bir reaksiyon için 1/[A]t‘ye karşı t‘nin bir grafiği, k eğimi ve 1/[A]0 Y kesişimi olan düz bir çizgidir. Arsa düz bir çizgi değilse, reaksiyon ikinci mertebeden değildir.
Sıfırıncı Derece Reaksiyonlar
Sıfır dereceli reaksiyonlar için, diferansiyel oran yasası oran = kA sıfır dereceli reaksiyon, reaktan (lar) ının konsantrasyonuna bakılmaksızın sabit bir reaksiyon hızı sergiler. Sıfır derece kinetikleri, yalnızca belirli belirli koşullar altında bazı reaksiyonlar için gözlemlenir. Bu aynı reaksiyonlar, belirli koşullar karşılanmadığında farklı kinetik davranışlar sergiler ve bu nedenle, bazen daha ihtiyatlı sözde sıfır derece terimi kullanılır.
Sıfır dereceli bir reaksiyon için entegre oran yasası da y = mx + b biçimini alan doğrusal bir fonksiyondur:
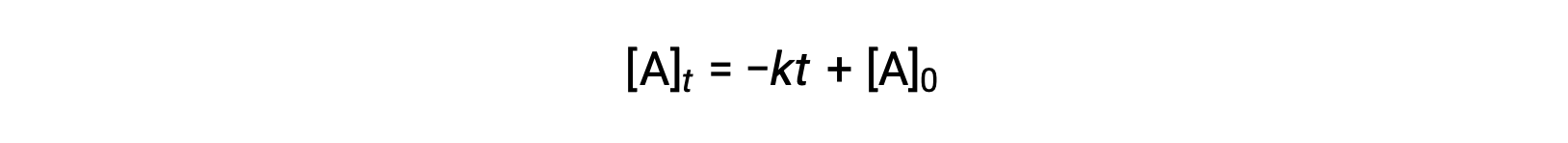
Sıfır dereceli reaksiyonlar için [A]t grafiği −k ve a y-bileşenlerinde doğrusaldır.
Bu metin bu kaynaktan uyarlanmıştır Openstax, Chemistry 2e, Section 12.4: Integrated Rate Laws.
