13.7:
Зависимость температуры от скорости реакции
13.7:
Зависимость температуры от скорости реакции
Теория столкновения
Атомы, молекулы или ионы должны столкнуться, прежде чем они смогут взаимодействовать друг с другом. Атомы должны быть близки друг к другу, чтобы образовывать химические связи. Эта предпосылка является основой теории, которая объясняет множество наблюдений относительно химической кинетики, включая факторы, влияющие на скорость реакции.
Теория столкновений основана на постулатах, что (i) скорость реакции пропорциональна скорости столкновений реагент, (II) столкновение участники реакции в ориентации, позволяющей контактировать между атомами, которые соединяются в продукте, и (iii) столкновение происходит с достаточной энергией, чтобы разрешить взаимное проникновение участники реакции’ валентные оболочки, чтобы электроны могли перегруппировать и сформировать новые связи (и новые химические виды).
Например, при газовой фазовой реакции между угарным газом и кислородом, возникающей при высокой температуре и давлении, первым шагом является столкновение между двумя молекулами.
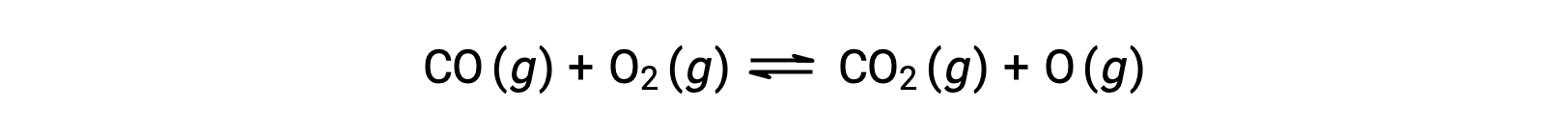
Однако может быть много различных относительных ориентаций, в которых сталкиваются две молекулы. Следовательно, ориентация сталкивающихся молекул имеет большое значение при частичном определении осуществимости реакции, происходящей между ними.
В одном случае кислородная сторона молекулы окиси углерода может столкнуться с молекулой кислорода. В другом случае углеродистая сторона молекулы окиси углерода может столкнуться с молекулой кислорода. Второй случай, скорее всего, приведет к образованию диоксида углерода, с центральным атомом углерода, связанным с двумя атомами кислорода (O = C = O).
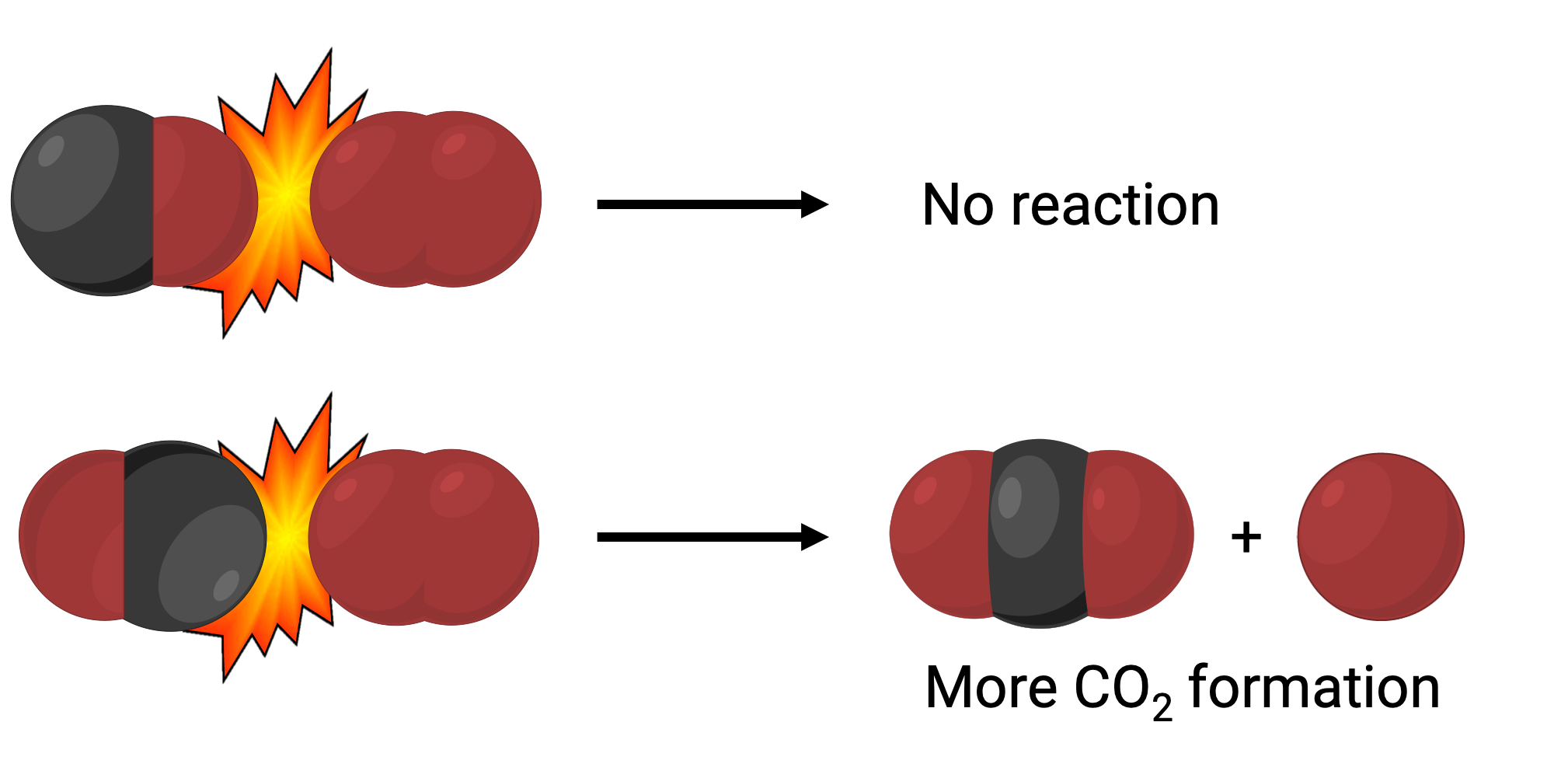
Тем не менее, даже если столкновение действительно происходит в правильной ориентации, гарантия того, что реакция будет продолжать образовывать углекислый газ, ограничена. Это связано с тем, что в дополнение к правильной ориентации столкновение также должно происходить с достаточной энергией, называемой энергией активации, чтобы привести к образованию продукта. Когда виды реагент сталкиваются как с правильной ориентацией, так и с достаточной энергией активации, они объединяются, чтобы сформировать нестабильный вид, называемый активированным комплексом или переходным состоянием. Эти виды недолговечны и обычно не поддаются обнаружению большинством аналитических инструментов. В некоторых случаях сложные спектральные измерения могут наблюдать за переходными состояниями.
Теория столкновений объясняет, почему большая часть скоростей реакции увеличивается по мере повышения температуры; при повышении температуры частота столкновений увеличивается. Чем больше столкновений, тем быстрее скорость реакции, если энергия столкновений достаточна.
Энергия активации
Минимальная энергия, необходимая для формирования продукта во время столкновения между реагенты, называется энергией активации (EA). Разница в требуемой энергии активации и кинетической энергии, обеспечиваемой столкновением молекул реагент, является основным фактором, влияющим на скорость химической реакции. Если энергия активации намного больше, чем средняя кинетическая энергия молекул, реакция будет происходить медленно, так как только несколько быстро движущихся молекул будут иметь достаточно энергии для реакции. Если энергия активации значительно меньше, чем средняя кинетическая энергия молекул, большая часть молекул будет достаточно энергичной, и реакция будет быстро продолжаться.
Диаграммы реакции широко используются в химической кинетике для иллюстрации различных свойств интересующей реакции. Она показывает, как меняется энергия химической системы при ее реакции, превращая реагенты в продукты.
Например, рассмотрим следующую схему реакции для экзотермической реакции: A + B → C + D;
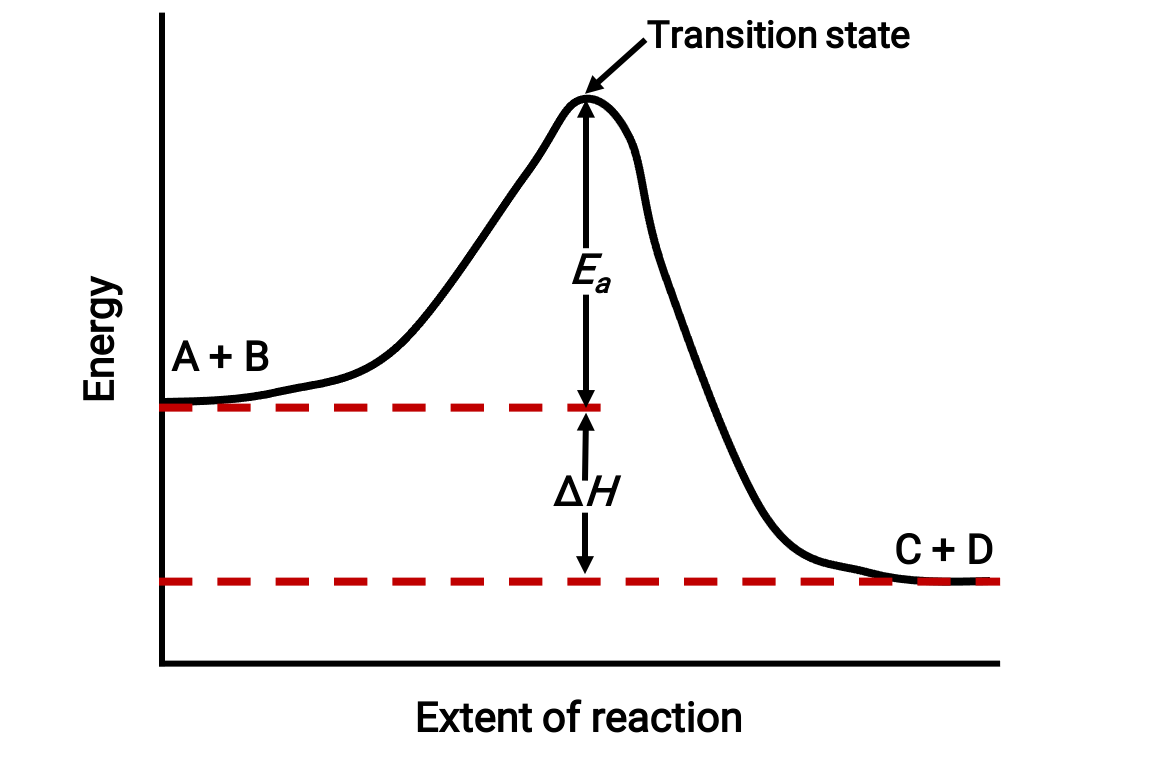
Схема показана слева направо. Изначально система состоит только из реагенты (A + B). После столкновения молекул реагент с достаточной энергией они образуют высокоэнергетический активированный комплекс или переходное состояние. Затем нестабильное переходное состояние распашется для получения стабильных продуктов (C + D).
На диаграмме показана энергия активации реакции, EA, как разность между энергией реагенты и состоянием перехода. Разность между энергией реагенты и продуктами соответствует изменению энтальпии реакции (ΔH). В этом случае реакция является экзотермической (ΔH < 0), так как она приводит к снижению энтальпии системы.
Уравнение Аррениуса
Уравнение Аррениуса, k = AE–EA/RT соотносит энергию активации и константу скорости, k, для многих химических реакций.
В этом уравнении R — идеальная газовая константа, которая имеет значение 8.314 Дж/моль·к, T — температура в кельвине, EA — энергия активации в джоулях на моль, e — константа 2.7183, а A — константа, называемая частотным коэффициентом, которая связана с частотой столкновений и ориентацией реагирующих молекул. Уравнение Аррениуса прекрасно подходит для постулатов теории столкновений. Коэффициент частоты A отражает, насколько хорошо условия реакции благоприятствуют правильно ориентированным столкновениям между молекулами реагент. Повышенная вероятность столкновения с эффективной ориентацией приводит к увеличению значений для более высокой скорости реакции.
Экспоненциальный термин e-EA/RT описывает влияние энергии активации на скорость реакции. Согласно молекулярно-кинетической теории, температура вещества является мерой средней кинетической энергии составляющих его атомов или молекул — более низкая энергия активации приводит к более значительной доле адекватно заряженных молекул и более быстрой реакции.
Экспоненциальный термин также описывает влияние температуры на скорость реакции. Более высокая температура представляет собой соответственно большую долю молекул, обладающих достаточной энергией (RT) для преодоления активационного барьера (EA). Это дает более высокое значение для постоянной скорости и соответственно более высокую скорость реакции.
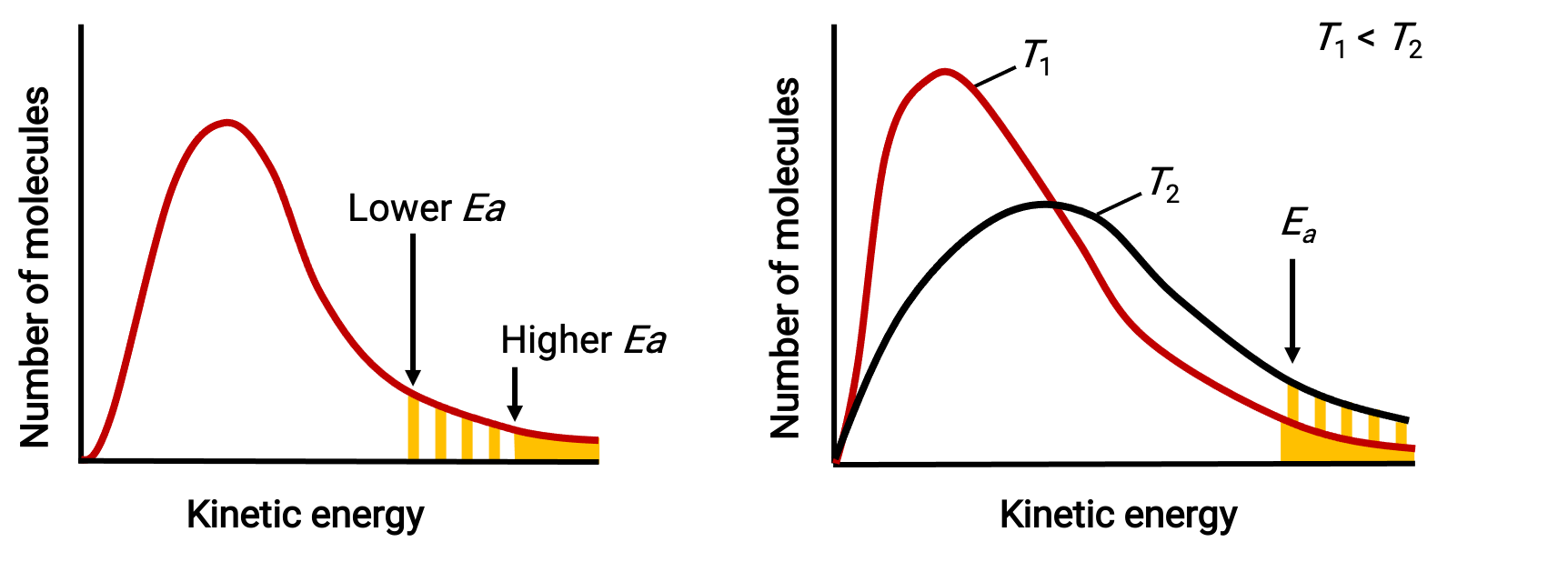
Распределение молекулярной энергии, показывающее количество молекул с энергиями, превышающими две разные энергии активации при заданной температуре, и заданной энергии активации при двух разных температурах.
Этот текст адаптирован из Openstax, Химия 2е изд., раздел 12.5: Теория столкновений.
