13.7: Dependencia de la Temperatura en la Velocidad de Reacción
La teoría de las colisiones
Los átomos, moléculas o iones deben colisionar antes de que puedan reaccionar entre sí. Los átomos deben estar cerca para formar enlaces químicos. Esta premisa es la base de una teoría que explica muchas observaciones con respecto a la cinética química, incluyendo factores que afectan las velocidades de reacción.
La teoría de las colisiones se basa en los postulados de que (i) la velocidad de reacción es proporcional a la velocidad de las colisiones de los reactivos, (ii) las especies que reaccionan chocan en una orientación que permite el contacto entre los átomos que se unen en el producto, y (iii) la colisión se produce con energía adecuada para permitir la penetración mutua de las capas de valencia de las especies que reaccionan, de modo que los electrones puedan reorganizarse y formar nuevos enlaces (y nuevas especies químicas).
Por ejemplo, en una reacción en fase gaseosa entre el monóxido de carbono y el oxígeno, que se produce a alta temperatura y presión, el primer paso es una colisión entre las dos moléculas.
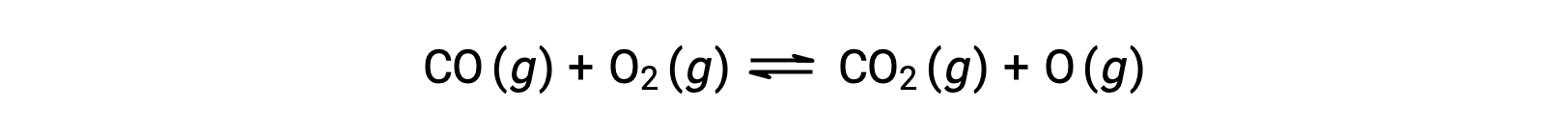
Sin embargo, podría haber muchas orientaciones relativas posibles diferentes en las cuales las dos moléculas colisionan. Por lo tanto, la orientación de las moléculas en colisión tiene gran importancia en la determinación parcial de la viabilidad de que ocurra una reacción entre ellas.
En un caso, el lado del oxígeno de la molécula de monóxido de carbono puede colisionar con la molécula de oxígeno. En otro caso, el lado del carbono de la molécula de monóxido de carbono puede colisionar con la molécula de oxígeno. Es más probable que el segundo caso dé lugar a la formación de dióxido de carbono, con un átomo central de carbono unido a dos átomos de oxígeno (O = C = O).
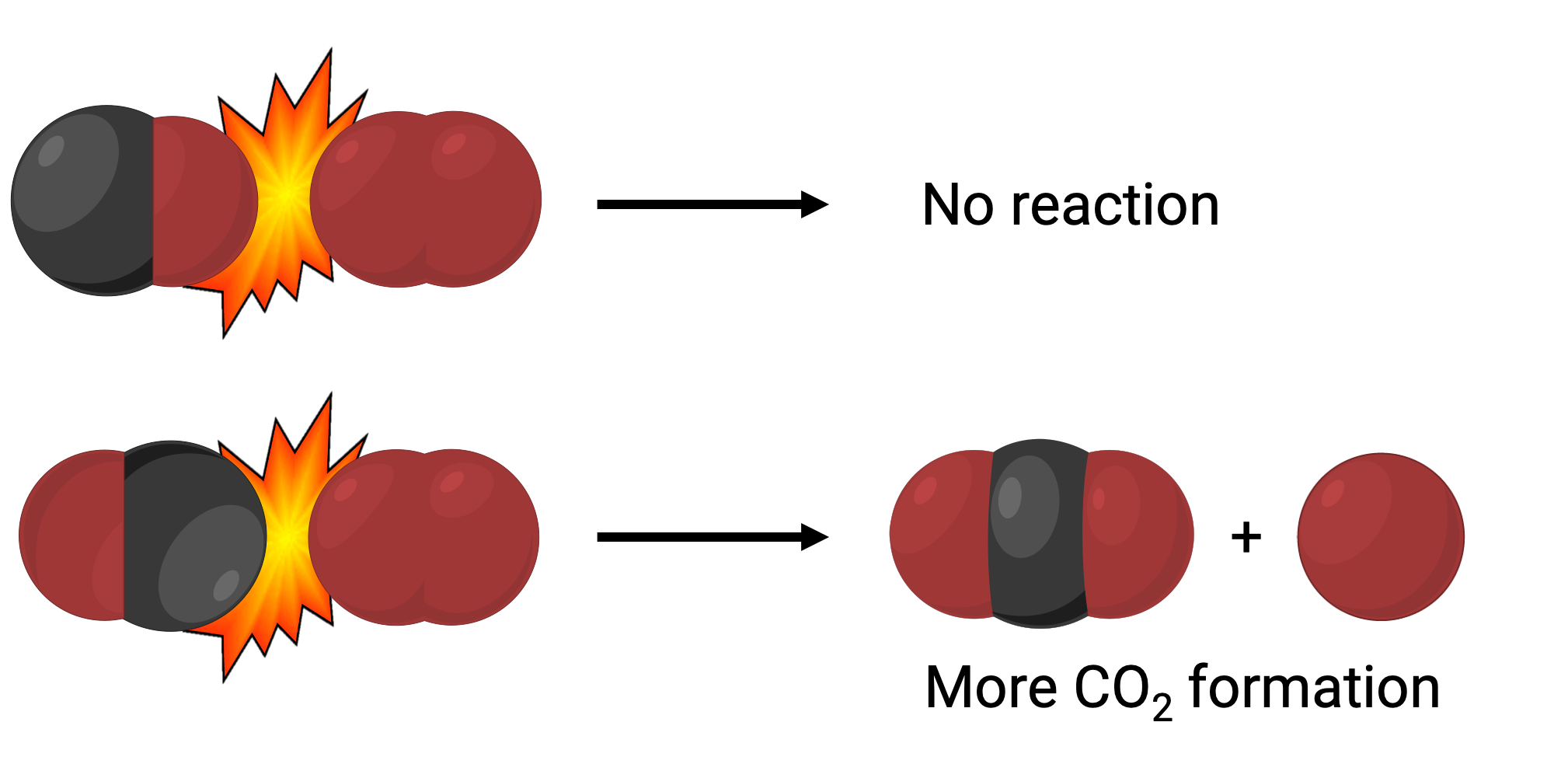
Sin embargo, incluso si la colisión tiene lugar en la orientación correcta, la garantía de que la reacción procederá a formar dióxido de carbono es limitada. Esto se debe a que, además de la orientación adecuada, la colisión también debe ocurrir con suficiente energía, llamada energía de activación, para dar lugar a la formación del producto. Cuando las especies reactantes chocan en orientación correcta y con suficiente energía de activación, se combinan para formar una especie inestable llamada complejo activado o estado de transición. Estas especies son de corta duración y generalmente indetectables por la mayoría de los instrumentos analíticos. En algunos casos, las mediciones espectrales sofisticadas pueden observar estados de transición.
La teoría de las colisiones explica por qué la mayoría de las velocidades de reacción aumentan a medida que aumenta la temperatura; con un aumento de la temperatura, aumenta la frecuencia de las colisiones. Más colisiones significan una velocidad de reacción más rápida, suponiendo que la energía de las colisiones es adecuada.
Energía de activación
La energía mínima necesaria para formar un producto durante una colisión entre reactivos se denomina energía de activación (Ea). La diferencia en la energía de activación requerida y la energía cinética proporcionada por las moléculas reactantes en colisión es un factor primario que afecta la velocidad de una reacción química. Si la energía de activación es mucho mayor que la energía cinética promedio de las moléculas, la reacción ocurrirá lentamente, ya que sólo unas pocas moléculas de movimiento rápido tendrán suficiente energía para reaccionar. Si la energía de activación es mucho más pequeña que la energía cinética promedio de las moléculas, una gran fracción de moléculas tendrá la energía suficiente, y la reacción procederá rápidamente.
Los diagramas de reacción se utilizan ampliamente en cinética química para ilustrar varias propiedades de una reacción de interés. Muestra cómo cambia la energía de un sistema químico a medida que sufre una reacción, convirtiendo los reactivos en productos.
Por ejemplo, considere el siguiente diagrama de reacción para una reacción exotérmica: A + B → C + D;
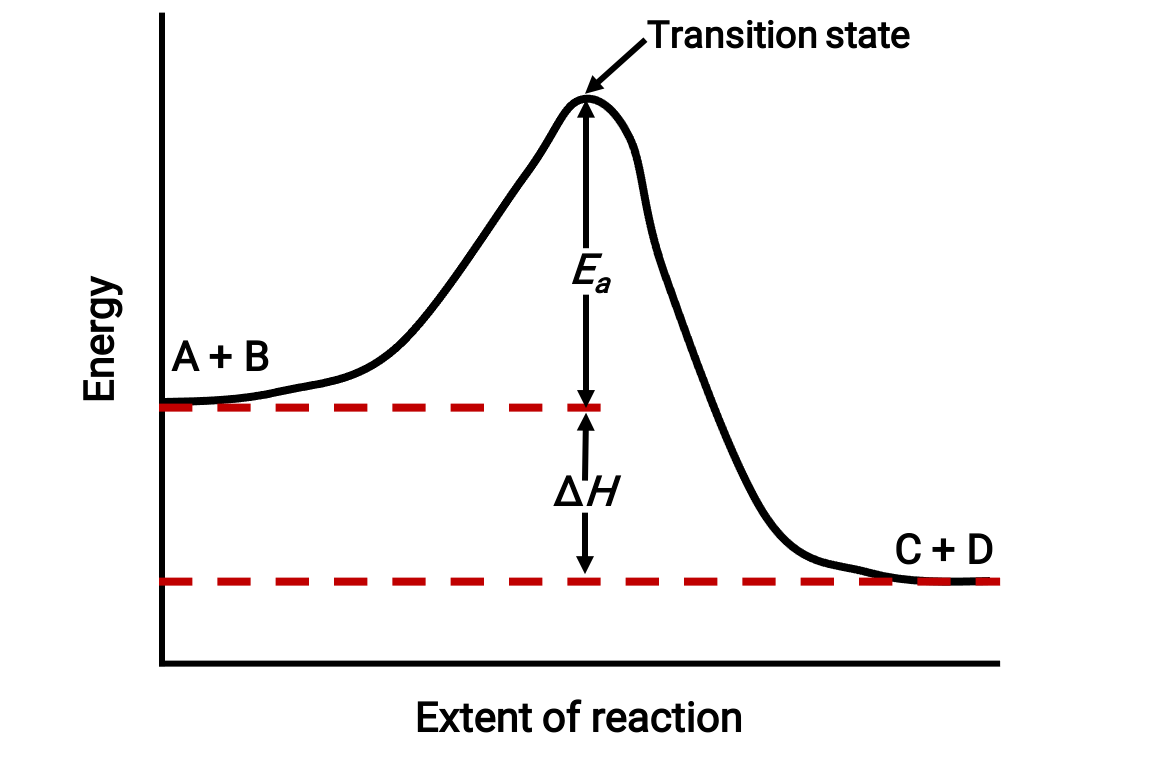
El diagrama se visualiza de izquierda a derecha. Inicialmente, el sistema sólo consta de reactivos (A + B). Una vez que las moléculas reactantes con suficiente energía colisionan, forman un complejo activado de alta energía o un estado de transición. A continuación, el estado de transición inestable decae para producir productos estables (C + D).
El diagrama muestra la energía de activación de la reacción, Ea, como la diferencia de energía entre los reactivos y el estado de transición. La diferencia de energía entre los reactivos y los productos corresponde al cambio de entalpía de la reacción (ΔH). En este caso, la reacción es exotérmica (ΔH < 0), ya que produce una disminución en la entalpía del sistema.
Ecuación de Arrhenius
La ecuación de Arrhenius, k =Ae−Ea/RT relaciona la energía de activación y la constante de velocidad,
En esta ecuación, R es la constante de gas ideal, que tiene un valor de 8,314 J/mol·K, T es la temperatura en kelvin, Ea es la energía de activación en jules por mol, e es la constante 2,7183, y A es una constante llamada factor de frecuencia, que está relacionado con la frecuencia de las colisiones y la orientación de las moléculas que reaccionan. La ecuación de Arrhenius se adapta perfectamente a los postulados de la teoría de las colisiones. El factor de frecuencia, A, refleja qué tan bien que las condiciones de reacción favorecen las colisiones correctamente orientadas entre moléculas reactivas. Una mayor probabilidad de colisiones eficientemente orientadas da como resultado valores mayores para una A y velocidad de reacción más rápidas.
El término exponencial, e−Ea/RT, describe el efecto de la energía de activación en la velocidad de reacción. Según la teoría cinético molecular, la temperatura de la materia es una medida de la energía cinética promedio de sus átomos o moléculas constituyentes; una energía de activación más baja resulta en una fracción más significativa de moléculas energizadas adecuadamente y una reacción más rápida.
El término exponencial también describe el efecto de la temperatura sobre la velocidad de reacción. Una temperatura más alta representa una fracción correspondientemente mayor de moléculas que poseen suficiente energía (RT) para superar la barrera de activación (Ea). Esto produce un valor más alto para la constante de velocidad y una velocidad de reacción más rápida.
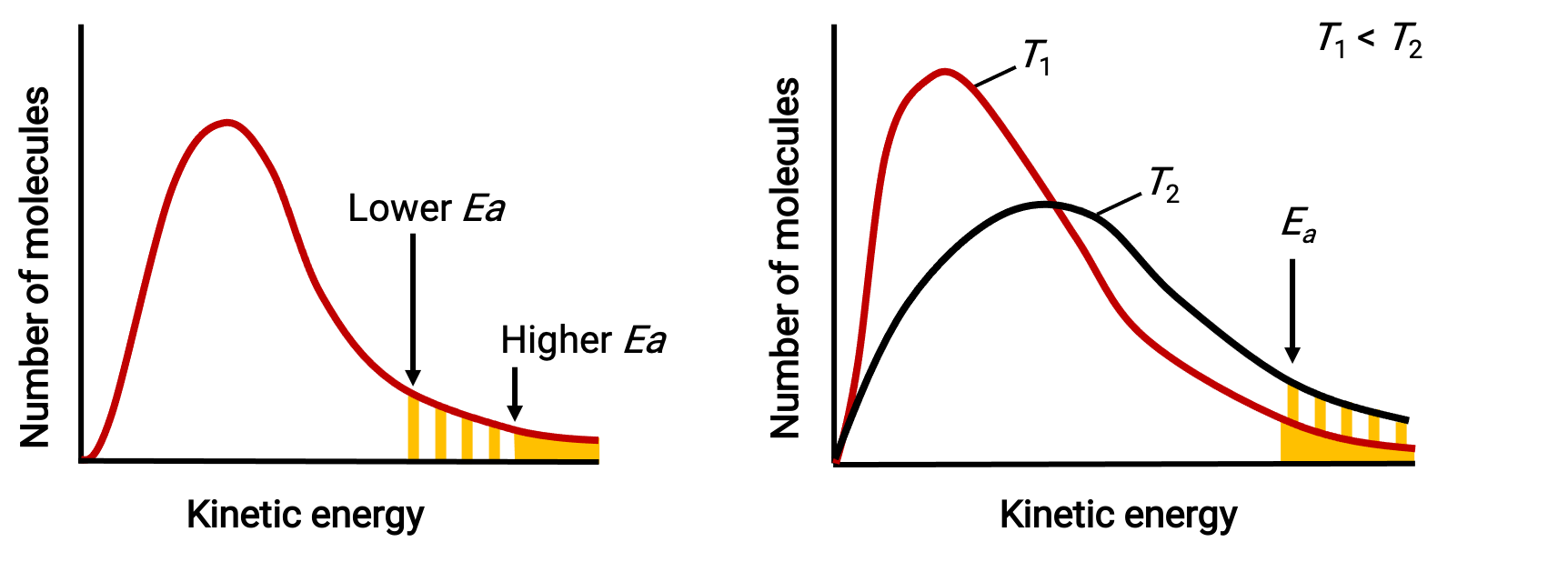
Las distribuciones de energía molecular muestran el número de moléculas con energías que exceden dos energías de activación diferentes a una temperatura dada, y una energía de activación dada a dos temperaturas diferentes.
Este texto es adaptado de Openstax, Química 2e, Sección 12.5: Teoría de las Colisiones.


