13.8:
Los Gráficos de Arrhenius
13.8:
Los Gráficos de Arrhenius
La ecuación de Arrhenius relaciona la energía de activación y la constante de velocidad, k, para las reacciones químicas. En la ecuación de Arrhenius, <em k = Ae−Ea/RT, donde R es la constante de gas ideal, que tiene un valor de 8,314 J/mol·K,T es la temperatura en la escala kelvin, Ea es la energía de activación en J/mol, e es la constante 2,7183, y A es una constante llamada factor de frecuencia, que está relacionado con la frecuencia de las colisiones y la orientación de las moléculas que reaccionan.
La ecuación de Arrhenius se puede utilizar para calcular la energía de activación de una reacción a partir de datos cinéticos experimentales. Un enfoque conveniente para determinar la Ea para una reacción implica la medición de k a dos o más temperaturas diferentes. Utiliza una versión modificada de la ecuación de Arrhenius que toma la forma de una ecuación lineal:
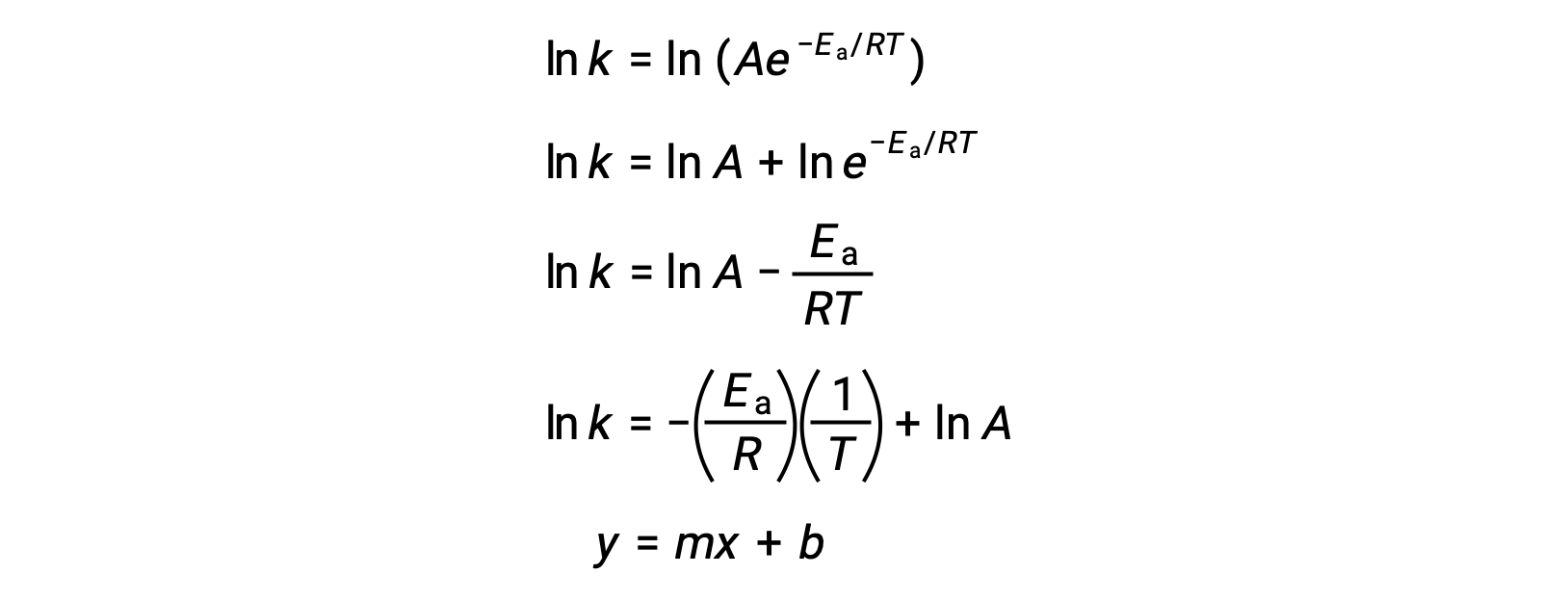
Un gráfico de lnk frente a 1/T es lineal con una pendiente igual a −Ea/R y una intercepción y igual a lnA.
Considere la siguiente reacción:
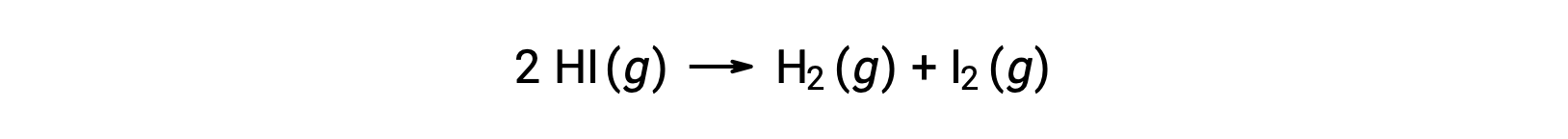
La energía de activación de esta reacción se puede determinar si la variación en la constante de velocidad con la temperatura se conoce a partir de los datos cinéticos de la reacción, como se muestra.
| Temperatura (K) | Constante de velocidad (L/mol/s) |
| 555 | 3,52 × 10–7 |
| 575 | 1,22 × 10–6 |
| 645 | 8,59 × 10–5 |
| 700 | 1,16 × 10–3 |
| 781 | 3,95 × 10–2 |
Los datos proporcionados pueden utilizarse para obtener los valores de la inversa de la temperatura (1/T) y el registro natural de k (lnk).
| 1/T (K–1) | nk |
| 1,80 × 10–3 | –14,860 |
| 1,74 × 10–3 | –13,617 |
| 1,55 × 10–3 | –9,362 |
| 1,43 × 10–3 | –6,759 |
| 1,28 × 10–3 | –3,231 |
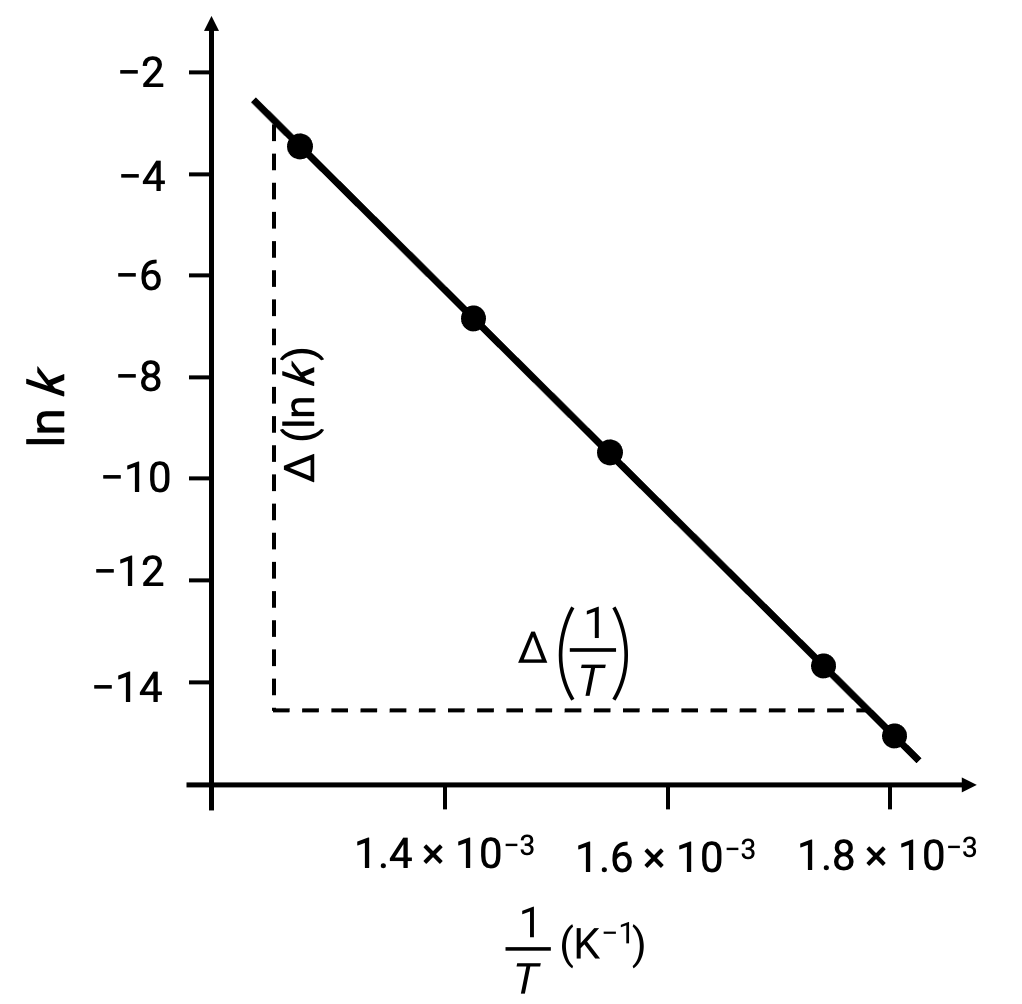
Al trazar los puntos de datos obtenidos con ln k frente a 1/T, se genera un gráfico de líneas que muestra una relación lineal entre lnk y 1/T, como se muestra.
La pendiente de la línea, que corresponde a la energía de activación, puede estimarse utilizando dos pares de datos experimentales cualesquiera.

Un enfoque alternativo para obtener la energía de activación implica la utilización de la constante de velocidad a dos temperaturas diferentes. En este enfoque, la ecuación de Arrhenius se reorganiza en una forma conveniente de dos puntos:
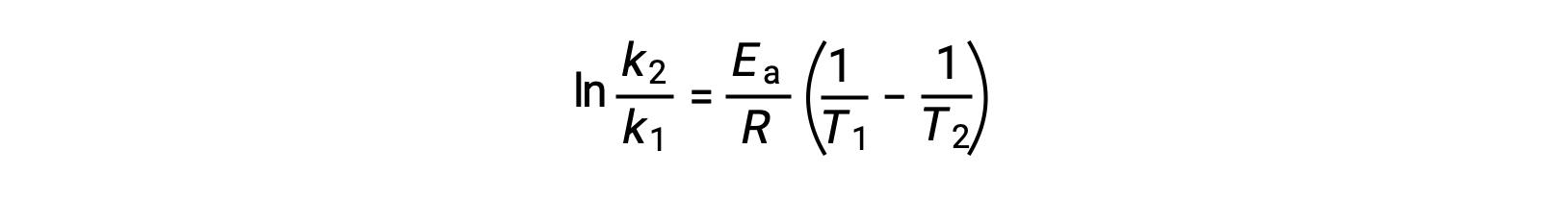
Al reorganizar la ecuación, se genera una expresión para la energía de activación.
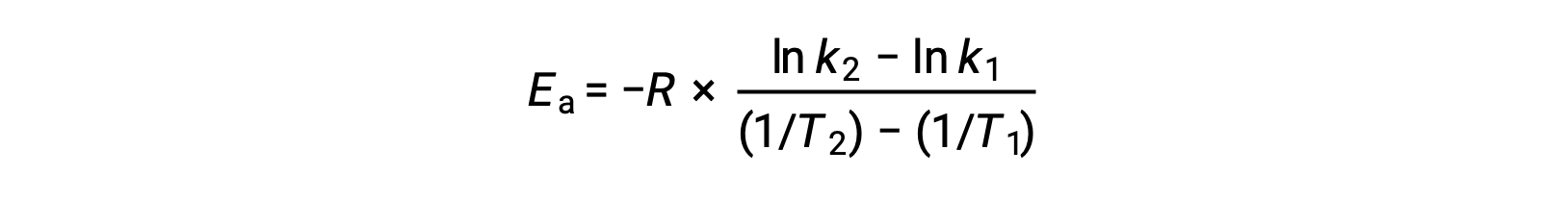
Al sustituir dos pares de datos cualesquiera y realizando los cálculos adicionales se obtiene el valor de la energía de activación en jules por mol o kilojules por mol.
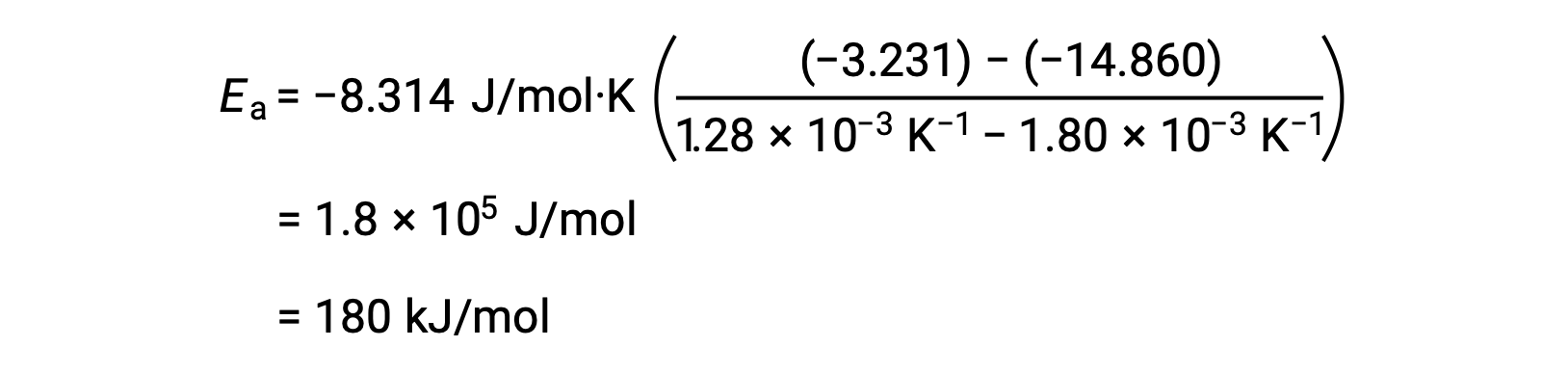
Este enfoque alternativo de dos puntos produce el mismo resultado que el enfoque gráfico. Sin embargo, en la práctica, el enfoque gráfico normalmente proporciona resultados más fiables mientras se trabaja con datos experimentales reales.
Este texto es adaptado de Openstax, Química 2e, Sección 12.5: Teoría de las Colisiones.
