13.11:
التحفيز
13.11:
التحفيز
يؤثر وجود عامل تحفيز في معدّل التفاعل الكيميائي. المحفّز هو مادة يمكنها زيادة معدّل التفاعل دون استهلاكها أثناء العملية. يمكن الحصول على فهم أساسي لدور العوامل المحفّزة’ أثناء التفاعلات الكيميائية من خلال مفهوم آليات التفاعل ومخطّطات الطاقة.
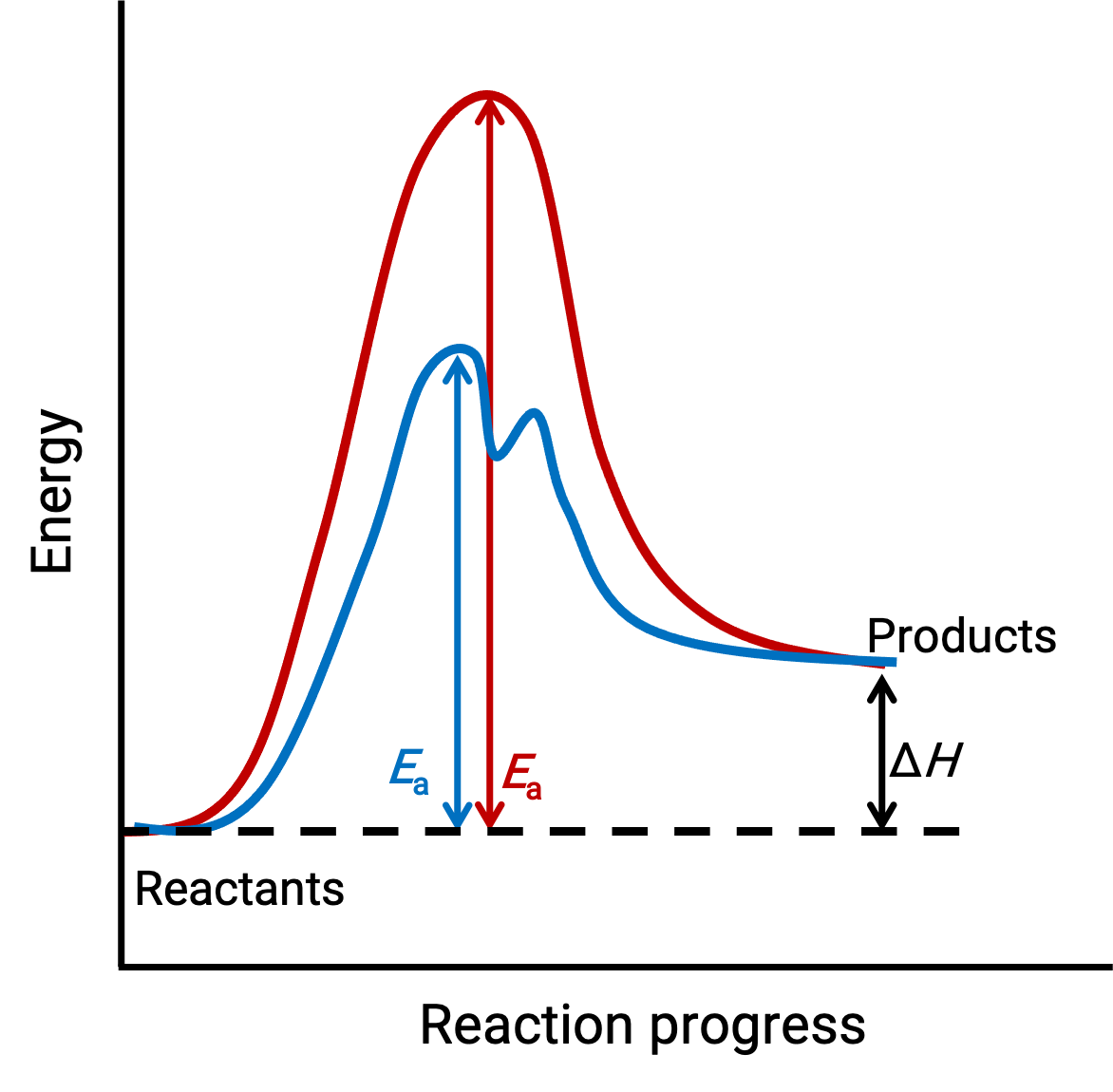
تمثل الصورة الموضحة الرسوم البيانية للتفاعل لعملية كيميائية ماصة للحرارة تتقدم في غياب (منحنى أحمر) ووجود (منحنى أزرق) العامل المحفّز.
يمثل كلا المنحنيين نفس التفاعل الكلي – يبدأون وينتهون بنفس الطاقات. (في هذه الحالة، تحتوي المنتجات على طاقة أكثر من المواد المتفاعلة. وبالتالي، يكون التفاعل ماصاً للحرارة). ومع ذلك، فإن آليات تفاعلهم مختلفة. يستمر التفاعل غير المحفّز عبر آلية من خطوة واحدة (مع حالة انتقال واحدة ملحوظة). في المقابل، يتبع التفاعل المحفّز آلية من خطوتين (لوحظت حالتان انتقاليتان) مع طاقة تنشيط أقل بشكل ملحوظ. يوضح هذا الاختلاف في مسارات التفاعل دور المحفّز’ في توفير آلية تفاعل بديلة مع طاقة تنشيط أقل، وبالتالي تسريع التفاعلات.
لا تحتاج آلية التفاعل المحفّز إلى تضمين عدد من الخطوات الأولية أكبر من الآلية غير المحفّزة. ومع ذلك، يجب أن يوفر مساراً بديلاً للتفاعل تكون خطوته لتحديد المعدل أسرع (مع طاقة أقل من Ea أو طاقة تنشيط).
يمكن تصنيف التفاعل المحفّز على أنه متجانس أو غير متجانس، بناءً على الحالات الفيزيائية التي توجد بها المحفّزات والمتفاعلات أثناء العملية التحفيزية.
التحفيز المتجانس
في التحفيز المتجانس، يكون المحفّز موجوداً في نفس الطور مثل المواد المتفاعلة – صلبة أو سائلة أو غازية. أثناء العملية، يتفاعل المحفّز مع المادة المتفاعلة لتكوين مادة وسيطة، والتي تتحلل بعد ذلك أو تتفاعل مع مادة تفاعل أخرى في خطوة واحدة أو أكثر لتجديد المحفّز الأصلي وتشكيل المنتج النهائي.
من الأمثلة على التحفيز المتجانس العملية الكيميائية التي تنطوي على تحلل الأوزون الذي يحدث في الغلاف الجوي العلوي للأرض’ الأوزون هو جزيء غير مستقر نسبياً يتحلّل لإنتاج الأكسجين ثنائي الذرة. يتوافق تفاعل التحلل مع الآلية التالية المكونة من خطوتين:
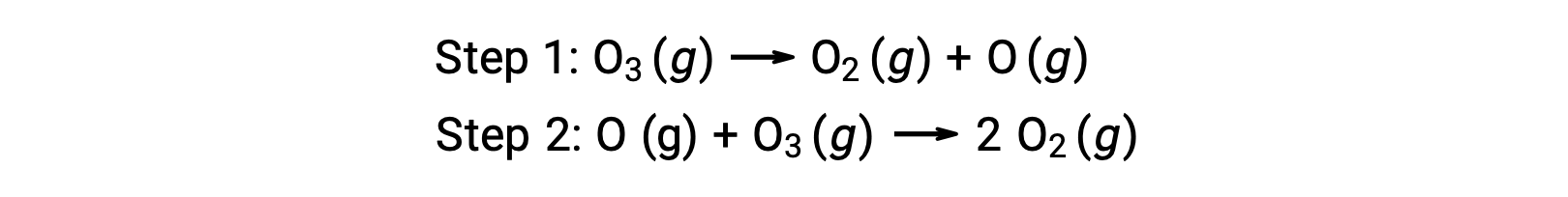
يمكن أن تحفّز العديد من المواد تحلل الأوزون. على سبيل المثال، يُعتقد أن تحلل الأوزون المحفّز بأكسيد النيتريك– يحدث عبر آلية الخطوات الثلاث التالية:
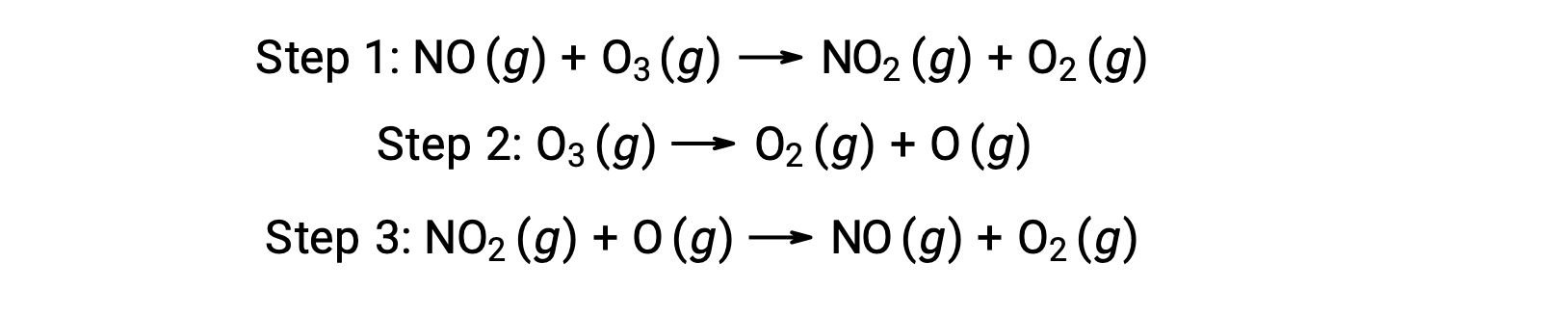
ومع ذلك، فإن التفاعل العام هو نفسه لكل من الآلية غير المحفّزة المكوّنة من خطوتين والآلية المحفّزة بـNO المكوّنة من ثلاث خطوات :
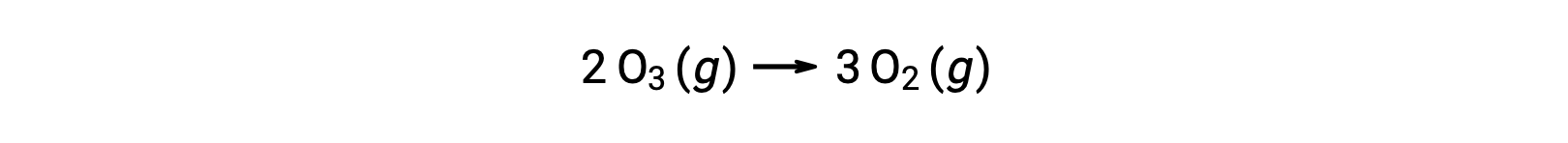
في التفاعل المحفّز، لاحظ أن أكسيد النيتروجين هو مادة متفاعلة في الخطوة الأولى للآلية ومنتج في الخطوة الأخيرة. هذه سمة مميزة أخرى للمحفّز: على الرغم من مشاركته في التفاعل الكيميائي، إلا أنه لا يتم استهلاكه بالتفاعل. بالإضافة إلى ذلك، في هذا التحفيز المتجانس، يوجد كلا من المادة المتفاعلة والمحفّز في الطور الغازي.
التحفيز غير المتجانس
في التحفيز غير المتجانس، يوجد المحفز في مرحلة مختلفة (عادة ما تكون صلبة) عن المواد المتفاعلة. تعمل هذه المحفّزات عموماً عن طريق توفير سطح نشط يمكن أن يحدث التفاعل عليه. تحدث تفاعلات الطور الغازي والسائل المحفّز بواسطة محفّزات غير متجانسة على سطح المحفّز وليس داخل الطور الغازي أو السائل.
عادةً ما يتضمن التحفيز غير المتجانس العمليات التالية:
- ادمصاص المادة (المواد) المتفاعلة على سطح المحفز
- تنشيط المتفاعلات الممتزة
- تفاعل المادة (المواد) المتفاعلة المدمصّة
- انتزاز المنتج (المنتجات) من سطح المحفّز
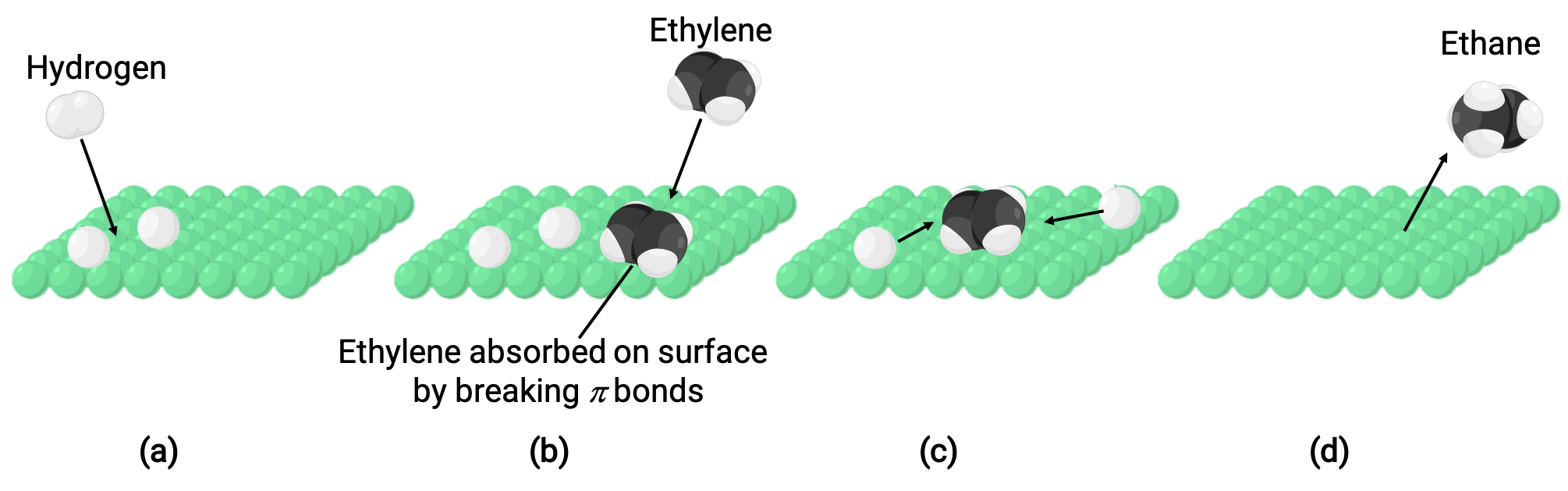
تمثل الصورة التوضيحية آلية التفاعل التي تتضمن التحفيز غير المتجانس للإيثين وغاز الهيدروجين على سطح نيكل صلب، لتكوين غاز الإيثان C2H4 + H2 ⟶ C2H6):
(أ) يتم ادمصاص الهيدروجين على سطح النيكل. أثناء هذه العملية، تنكسر روابط هيدروجين-هيدروجين لتكوين روابط نيكل-هيدروجين.
(ب) يتم ادمصاص الإيثين أيضاً على سطح النيكل عن طريق تكسير رابطة كربون-كربون وتشكيل روابط كربون–نيكل.
(ج) تنتشر ذرات الهيدروجين عبر السطح وتشكل روابط كربون-هيدروجين جديدة عندما تصطدم لتكوين إيثان (C2H6).
(د) يتم امتزاز جزيئات الإيثان من سطح النيكل.
يستخدم التحفيز غير المتجانس لتصنيع منتجات كيميائية صناعية مثل الأمونيا وحمض النيتريك وحمض الكبريتيك والميثانول. تُستخدم المحفزات غير المتجانسة أيضاً في المحوّلات المحفّزة الموجودة في معظم السيارات التي تعمل بالبنزين.
تم اقتباس هذا النص من Openstax, Chemistry 2e, Section 12.7: Catalysis.
