13.11:
Catálisis
13.11:
Catálisis
La presencia de un catalizador afecta la velocidad de una reacción química. Un catalizador es una sustancia que puede aumentar la velocidad de la reacción sin consumirse durante el proceso. Una comprensión básica del papel de los catalizadores durante las reacciones químicas puede entenderse a partir del concepto de los mecanismos de reacción y los diagramas de energía.
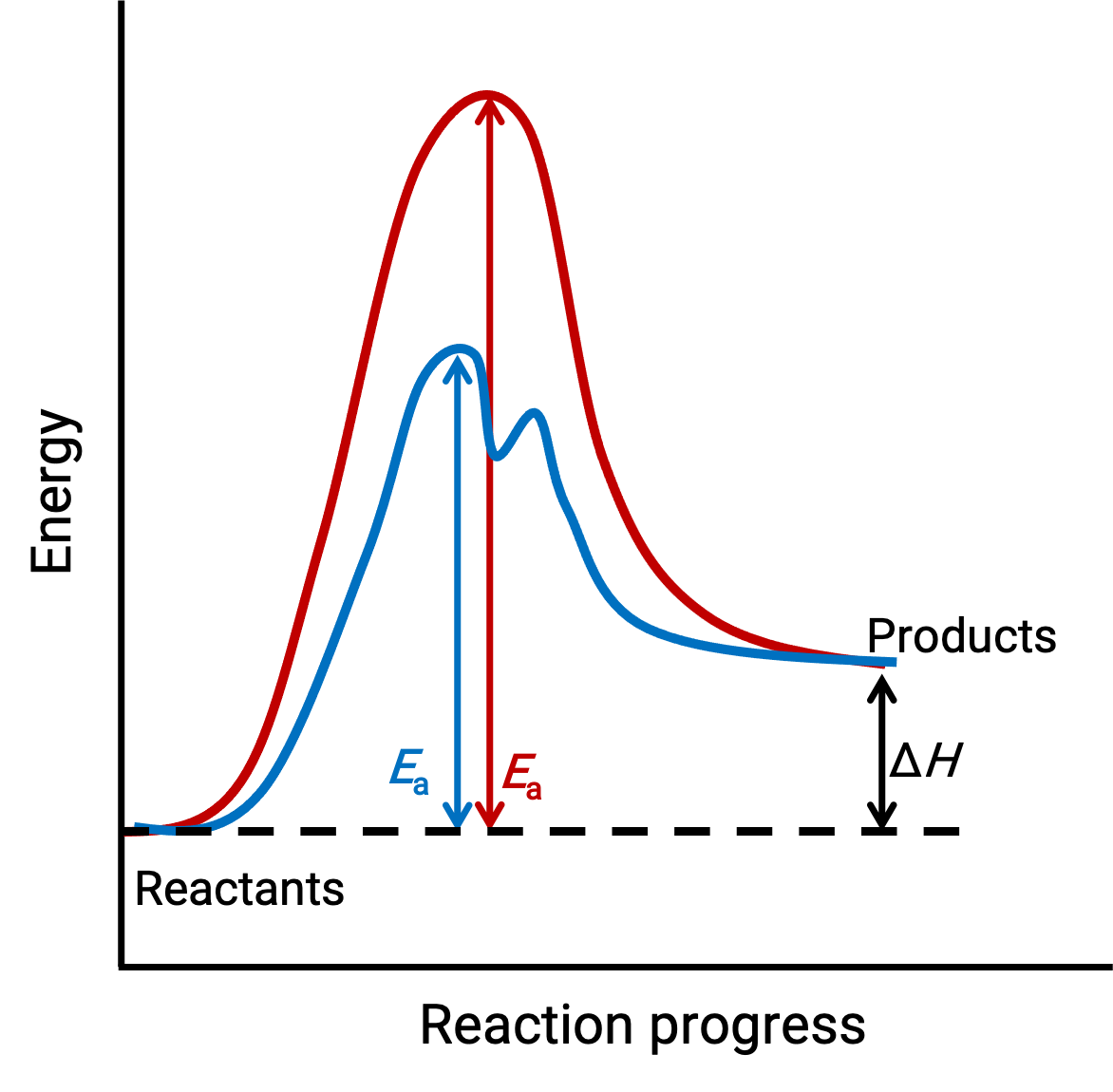
La imagen ilustrada representa los diagramas de reacción de un proceso químico endotérmico que progresa en ausencia (curva roja) y en presencia (curva azul) de un catalizador.
Ambas curvas representan la misma reacción general – comienzan y terminan en las mismas energías. (En este caso, los productos tienen más energía que los reactivos. Por lo tanto, la reacción es endotérmica). Sin embargo, sus mecanismos de reacción son diferentes. La reacción no catalizada procede a través de un mecanismo de un solo paso (con sólo un estado de transición observado). En cambio, la reacción catalizada sigue un mecanismo de dos pasos (se observan dos estados de transición) con una energía de activación notablemente inferior. Esta diferencia en las rutas de la reacción ilustra el papel del catalizador en proporcionar un mecanismo de reacción alternativo con menor energía de activación, acelerando así las reacciones.
El mecanismo de reacción catalizado no necesita involucrar un mayor número de pasos elementales que el mecanismo no catalizado. Sin embargo, debe proporcionar una ruta de reacción alternativa cuyo paso determinante de la velocidad sea más rápido (con una Ea o energía de activación más baja).
Una reacción catalítica puede clasificarse como homogénea o heterogénea, basándose en los estados físicos en que existen los catalizadores y los reactivos durante el proceso catalítico.
Catálisis homogénea
En la catálisis homogénea, el catalizador está presente en la misma fase que los reactivos: Sólido, líquido o gas. Durante el proceso, el catalizador interactúa con el reactivo para formar una sustancia intermedia, que luego se descompone o reacciona con otro reactivo en uno o más pasos para regenerar el catalizador original y formar el producto final.
Un ejemplo de catálisis homogénea es el proceso químico que implica la descomposición del ozono que se produce en la atmósfera superior de la Tierra. El ozono es una molécula relativamente inestable que se descompone para producir oxígeno diatómico. Esta reacción de descomposición es coherente con el siguiente mecanismo de dos pasos:
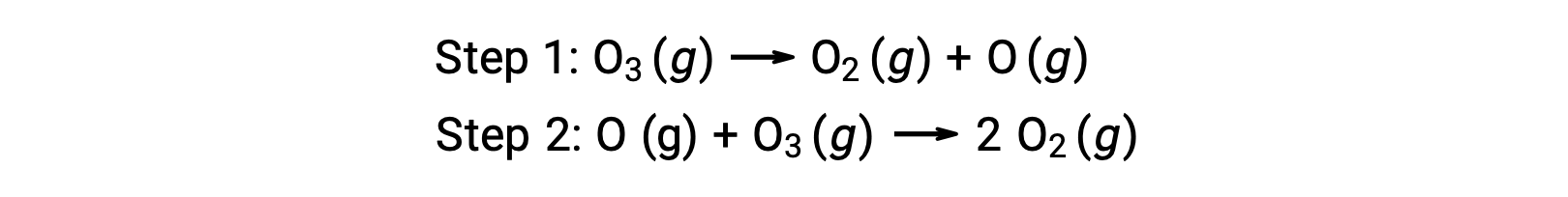
Muchas sustancias pueden catalizar la descomposición del ozono. Por ejemplo, se cree que la descomposición del ozono catalizada por óxido nítrico se produce a través del siguiente mecanismo de tres pasos:
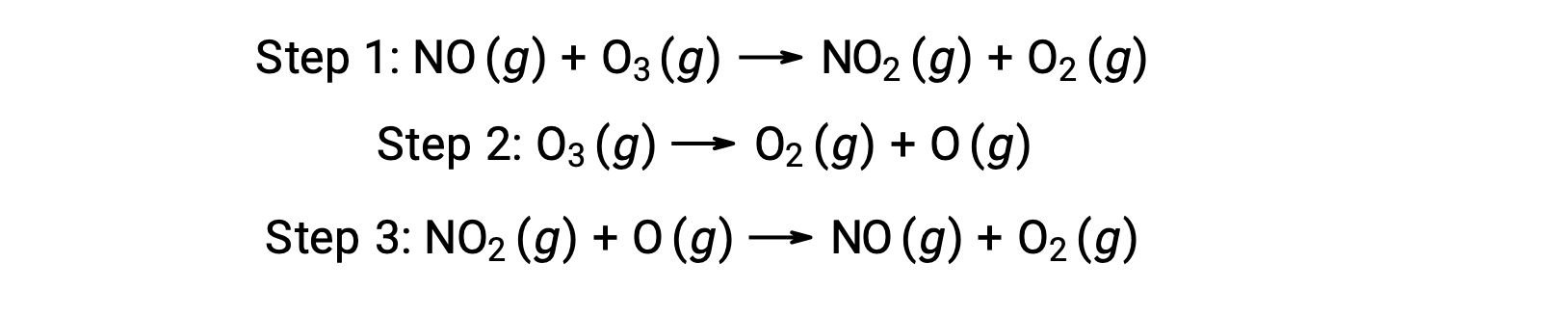
Sin embargo, la reacción general es la misma tanto para el mecanismo de dos pasos no catalizado como para el mecanismo de tres pasos catalizado por NO:
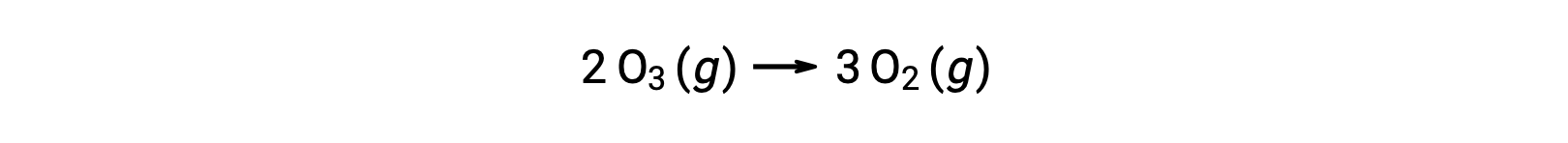
En la reacción catalizada, observe que NO es un reactivo en el primer paso del mecanismo y un producto en el último paso. Este es otro rasgo característico de un catalizador: Aunque participa en la reacción química, no es consumido por la reacción. Además, en esta catálisis homogénea, tanto el reactivo como el catalizador se encuentran en fase gaseosa.
Catálisis heterogénea
En la catálisis heterogénea, el catalizador está presente en una fase diferente (generalmente un sólido) a la de los reactivos. Tales catalizadores funcionan generalmente proporcionando una superficie activa sobre la cual puede ocurrir una reacción. Las reacciones en fase gaseosa y líquida catalizadas por catalizadores heterogéneos ocurren en la superficie del catalizador en lugar de dentro de la fase gaseosa o líquida.
La catálisis heterogénea suele implicar los siguientes procesos:
- Adsorción del reactivo o reactivos en la superficie del catalizador
- Activación de los reactivos adsorbidos
- La reacción de los reactivos adsorbidos
- Desorción del producto o productos en la superficie del catalizador
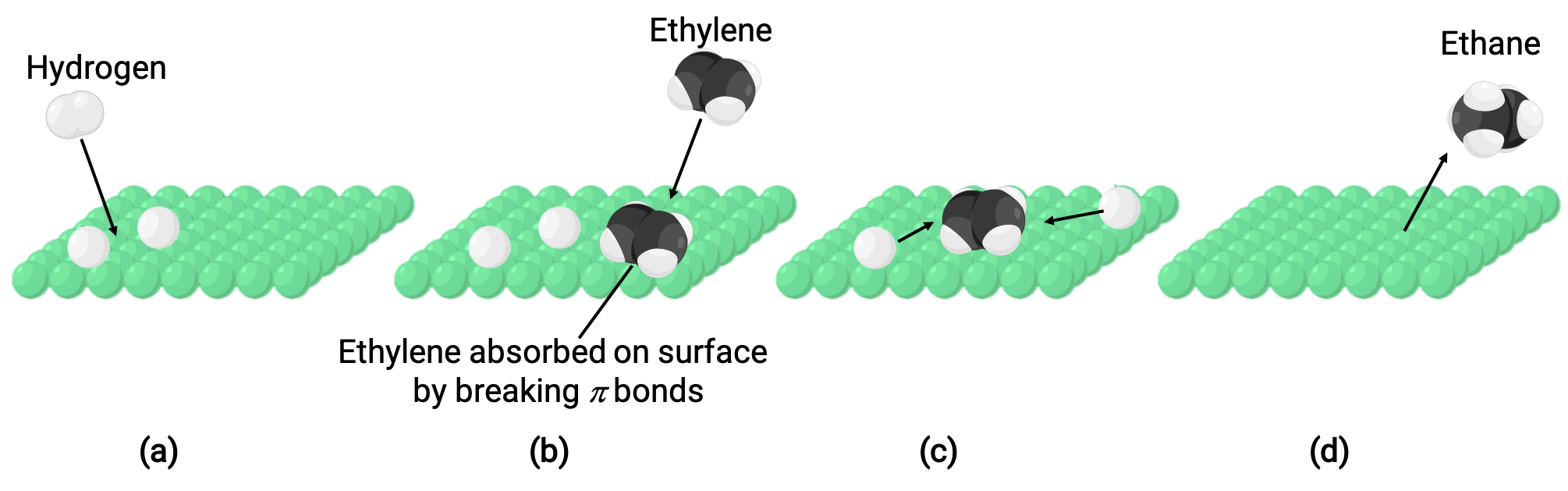
La imagen ilustrada representa el mecanismo de reacción que involucra la catálisis heterogénea del eteno y del gas hidrógeno en una superficie sólida de níquel, formando gas etano (C2H4 + H2 ⟶ C2H6):
(A) El hidrógeno se adsorbe en la superficie del níquel. Durante el proceso, los enlaces hidrógeno-hidrógeno se rompen para formar enlaces níquel-hidrógeno.
(b) El eteno también se adsorbe en la superficie del níquel rompiendo el enlace pi carbono-carbono y formando enlaces níquel-carbono.
(c) Los átomos de hidrógeno difunden a través de la superficie y forman nuevos enlaces carbono-hidrógeno cuando colisionan para formar etano (C2H6).
(D) Moléculas de metano se desorben de la superficie del níquel.
La catálisis heterogénea se utiliza para la fabricación industrial de productos químicos como el amoníaco, el ácido nítrico, el ácido sulfúrico y el metanol. Los catalizadores heterogéneos también se utilizan en los convertidores catalíticos que se encuentran en la mayoría de los automóviles alimentados con gasolina.
Este texto está adaptado de Openstax, Chemistry 2e, Sección 12,7: Catálisis.
