13.11:
触媒作用
13.11:
触媒作用
触媒の存在は化学反応の速度に影響を与えます。触媒は、プロセス中に消費されることなく反応速度を上げることができる物質です。触媒の化学反応中における役割は、反応メカニズムとエネルギー図の概念から理解できます。

この図は、触媒の非存在下(赤い曲線)と存在下(青い曲線)で進行する吸熱化学プロセスの反応図を表しています。
両方の曲線は同じ全体的な反応を表している–それらは同じエネルギーで始まり、同じエネルギーで終わります。 (この場合、生成物は反応物よりも多くのエネルギーを持っています。したがって、反応は吸熱反応である)。ただし、それらの反応メカニズムは異なります。触媒されていない反応は、ワンステップメカニズムを介して進行します(遷移状態が1つだけ観察される)。対照的に、触媒反応は、著しく低い活性化エネルギーで2段階のメカニズム(2つの遷移状態が観察される)に従う。反応経路のこの違いは、より低い活性化エネルギーで代替反応メカニズムを提供し、それによって反応を加速するという触媒の役割を示しています。
どちらの曲線も同じ全体反応を表しており、開始と終了時のエネルギーはそれぞれ等しい(この場合、生成物は反応物よりも大きなエネルギーを持ちます。したがって、この反応は吸熱性である)。 しかし、これらの反応メカニズムは異なります。無触媒反応は、1段階のメカニズムで進行する(観察される遷移状態は1つだけである)。一方、触媒反応は2段階のメカニズム(2つの遷移状態が観察される)をたどり、活性化エネルギーは格段に小さくなります。このような反応経路の違いは、より低い活性化エネルギーを持つ代替の反応メカニズムを提供することで、反応を促進するという触媒の役割を示しています。
触媒反応機構は、無触媒反応機構よりも素過程の数が多い必要はないが、律速段階がより速くなる(Eaまたは活性化エネルギーが低くなる)ような代替反応経路が新たに形成される必要があります。
触媒反応は、触媒プロセス中に触媒と反応物が存在する物理的な状態に基づいて、均一系と不均一系に分類されます。
均一系触媒
均一系触媒では、触媒は反応物と同じ相(固体、液体、気体)に存在します。プロセス中、触媒は反応物と相互作用して反応中間体を形成し、その中間体が1つ以上のステップで分解または別の反応物と反応して元の触媒を再生し、最終的な生成物をつくます。
均一系触媒反応の例として、地球上の高層大気中で発生するオゾンの分解を伴う化学プロセスが挙げられます。オゾンは比較的不安定な分子であり、分解すると二原子酸素が発生します。この分解反応は、次のような2段階のメカニズムから成ます。
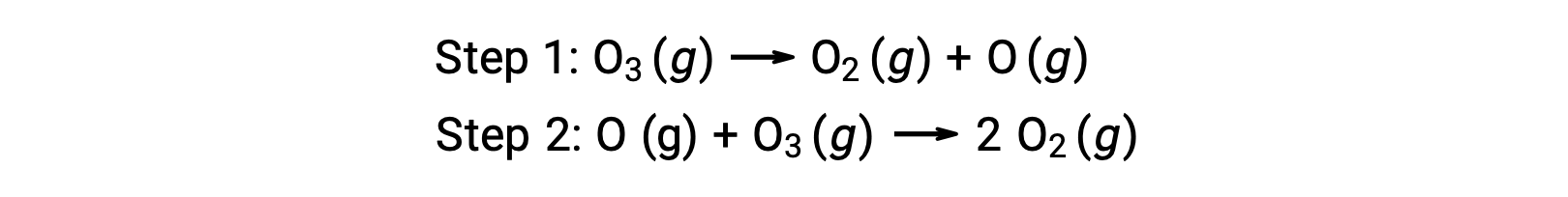
多くの物質がオゾンの分解を触媒します。例えば、一酸化窒素を触媒とするオゾンの分解は、次のような3段階のメカニズムで起こると考えられています。
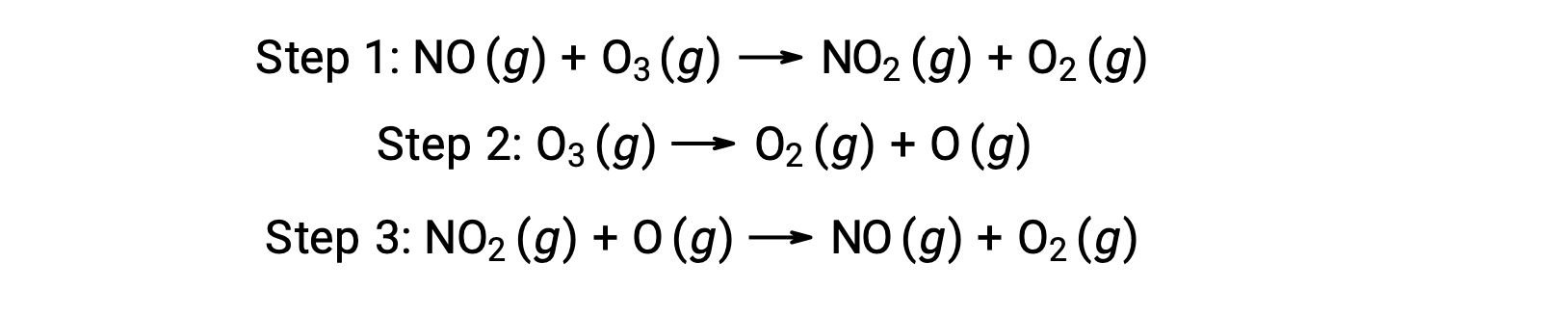
しかし、2段階の無触媒メカニズムでも3段階のNO触媒メカニズムでも、全体の反応は同じです。
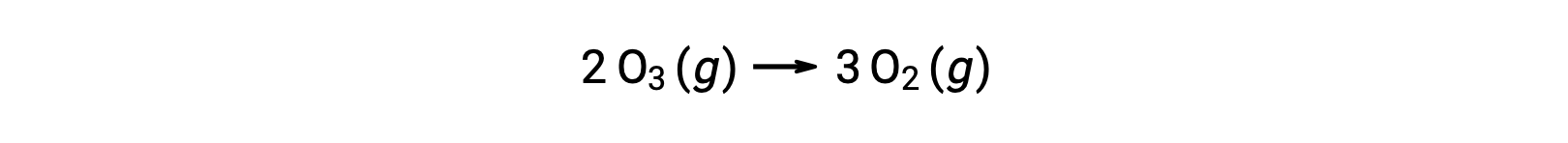
触媒反応では、NOがメカニズムの最初のステップで反応物となり、最後のステップで生成物となっていることに注目しましょう。これが触媒の特徴の1つであり、化学反応には参加するものの、反応全体で消費されることはありません。また、この均一系触媒反応では、反応物と触媒の両方が気体の状態で存在しています。
不均一系触媒
不均一系触媒反応では、触媒は反応物とは異なる相(通常は固体)に存在します。このような触媒は一般的に、反応を起こすための活性表面を提供することで機能します。不均一系触媒による気相・液相反応は、気相・液相内ではなく、触媒の表面で起こります。
不均一系触媒反応には、一般的に次のようなプロセスからなります。
- 触媒の表面への反応物の吸着
- 吸着した反応物の活性化
- 吸着した反応物の反応
- 触媒表面からの生成物の脱離
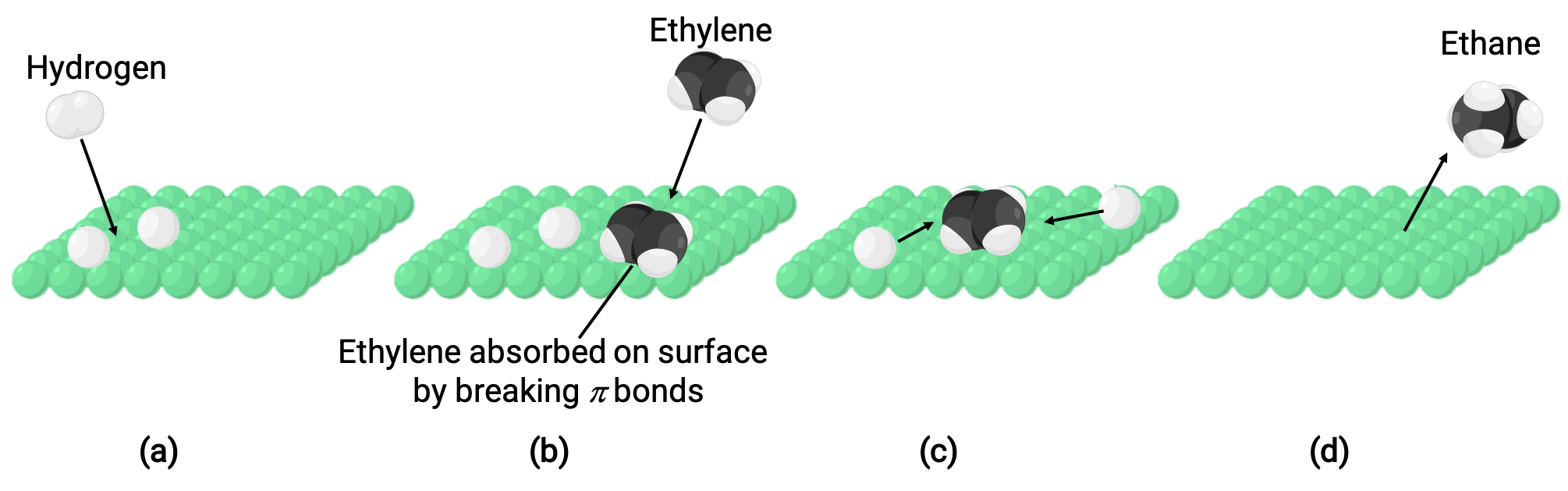
図は、固体ニッケル表面上でエテンと水素ガスが不均一触媒反応を起こし、エタンガスが生成される反応メカニズム(C2H4+ H2⟶ C2H6)を示したものです。
(a) ニッケルの表面に水素が吸着します。その際、水素と水素の結合が切れて、ニッケルと水素の結合が生成します。
(b) また、エチレンは、炭素-炭素のπ結合を切断してニッケル–炭素結合を形成することで、ニッケル表面に吸着します。
(c) 水素原子は表面を拡散し、衝突して新たな炭素-水素結合を形成することで、エタン(C2H6)が生成します。
(d) エタン分子がニッケル表面から脱離します。
不均一系触媒は、アンモニア、硝酸、硫酸、メタノールなどの化学製品を工業的に製造するために用いられます。また、ガソリン車に搭載されている触媒コンバーターにも不均一系触媒が使用されています。
上記の文章は以下から引用しました。 Openstax, Chemistry 2e, Section 12.7: Catalysis.
