13.11:
Catálise
13.11:
Catálise
A presença de um catalisador afeta a velocidade de uma reação química. Um catalisador é uma substância que pode aumentar a velocidade de reação sem ser consumida durante o processo. A compreensão básica do papel dos catalisadores durante as reações químicas pode ser entendida a partir do conceito de mecanismos de reação e diagramas de energia.
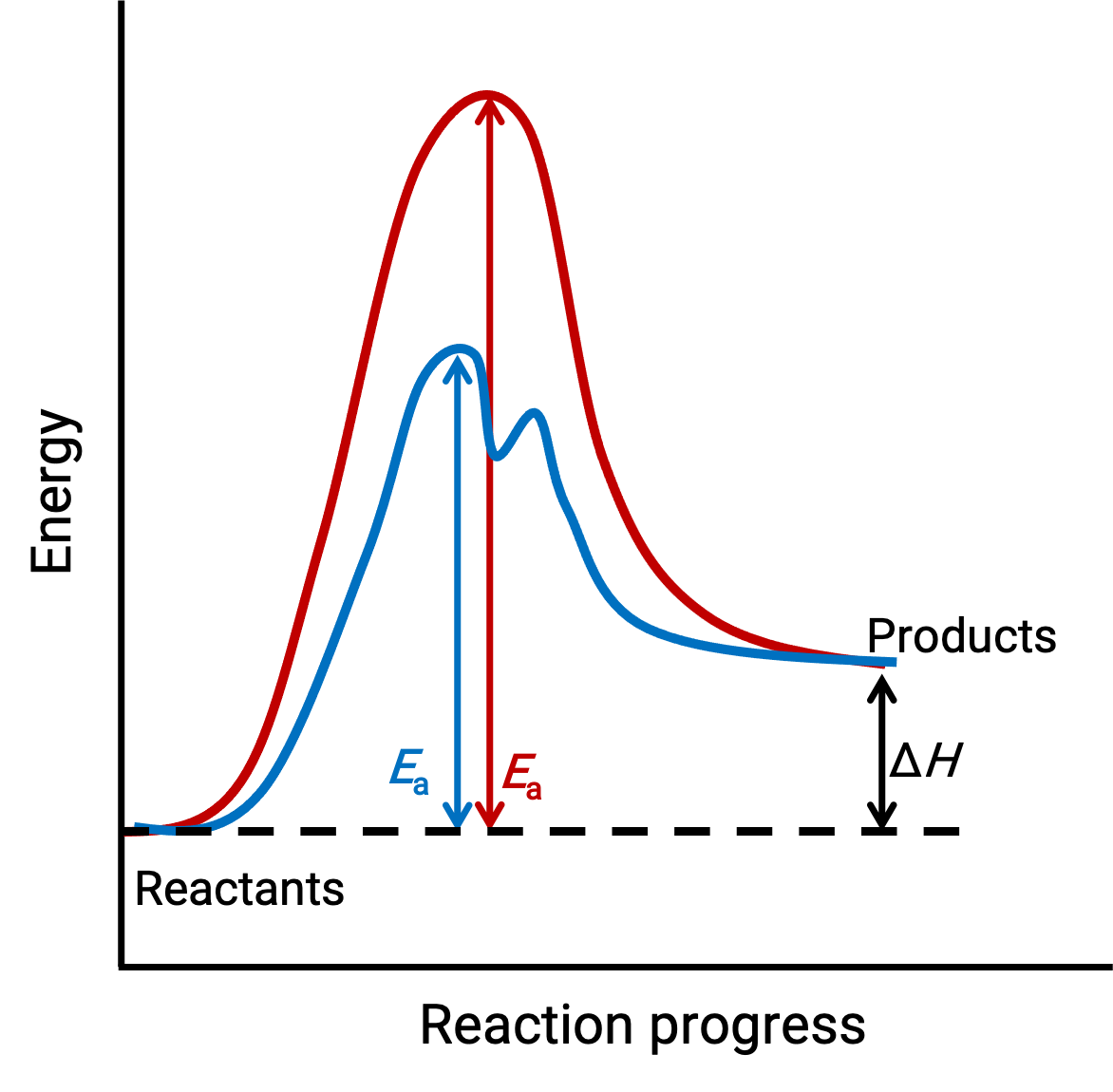
A imagem ilustrada representa os diagramas de reação para um processo químico endotérmico progredindo na ausência (curva vermelha) e presença (curva azul) de um catalisador.
Ambas as curvas representam a mesma reação geral – começam e terminam com as mesmas energias. (Neste caso, os produtos têm mais energia do que reagentes. Portanto, a reação é endotérmica). No entanto, os seus mecanismos de reação são diferentes. A reação não catalisada prossegue através de um mecanismo de um passo (com apenas um estado de transição observado). Em contraste, a reação catalisada segue um mecanismo de dois passos (dois estados de transição são observados) com energia de ativação notavelmente menor. Esta diferença nas vias de reação ilustra o papel do catalisador no fornecimento de um mecanismo de reação alternativo com menor energia de ativação, acelerando assim as reações.
O mecanismo de reação catalisada não precisa envolver um maior número de etapas elementares do que o mecanismo não catalisado. No entanto, deve fornecer um caminho de reação alternativo cujo passo determinante de velocidade seja mais rápido (com uma menor Ea ou energia de ativação).
Uma reação catalítica pode ser categorizada como homogénea ou heterogénea, com base nos estados físicos em que existem os catalisadores e reagentes durante o processo catalítico.
Catálise Homogénea
Em uma catálise homogénea, o catalisador está presente na mesma fase que os reagentes – sólido, líquido, ou gás. Durante o processo, o catalisador interage com o reagente para formar uma substância intermédia que, em seguida, decompõe ou reage com outro reagente em um ou mais passos para regenerar o catalisador original e formar o produto final.
Um exemplo de catálise homogénea é o processo químico que envolve a decomposição do ozono existente na atmosfera superior da Terra. O ozono é uma molécula relativamente instável que se decompõe para produzir oxigénio diatómico. Esta reação de decomposição é consistente com o seguinte mecanismo de dois passos:
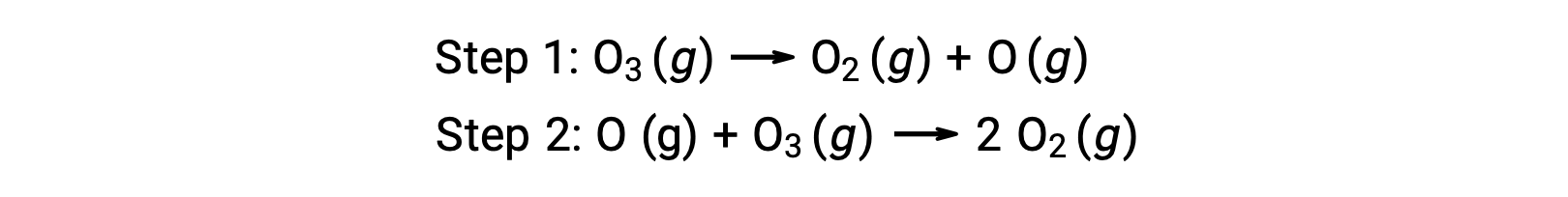
Muitas substâncias podem catalisar a decomposição do ozono. Por exemplo, acredita-se que a decomposição catalisada do ozono pelo óxido nítrico ocorra através do seguinte mecanismo de três passos:
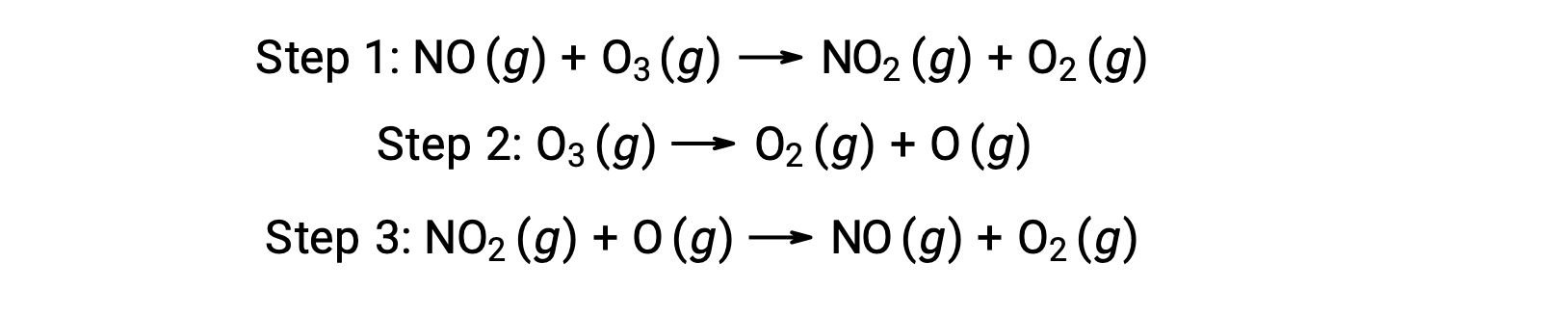
No entanto, a reação global é a mesma tanto para o mecanismo não catalisado de dois passos como para o mecanismo de três passos catalisado por NO:
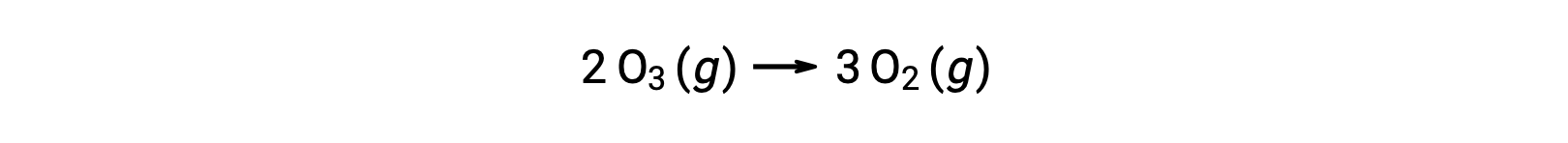
Na reação catalisada, observe que NO é um reagente na primeira etapa do mecanismo e um produto na última etapa. Esta é outra característica particular de um catalisador: Embora participe da reação química, não é consumido pela reação. Além disso, nesta catálise homogénea, tanto o reagente como o catalisador existem em fase gasosa.
Catálise Heterogénea
Em uma catálise heterogénea, o catalisador está presente em uma fase diferente (geralmente sólida) da dos reagentes. Tais catalisadores funcionam geralmente fornecendo uma superfície ativa em cima da qual uma reação pode ocorrer. Reações de fase gasosa e líquida catalisadas por catalisadores heterogéneos ocorrem na superfície do catalisador, em vez de dentro da fase de gás ou líquido.
Uma catálise heterogénea normalmente envolve os seguintes processos:
- Adsorção do(s) reagente(s) na superfície do catalisador
- Ativação do(s) reagente(s) adsorvido(s)
- A reação do(s) reagente(s) adsorvido(s)
- Dessorção do(s) produto(s) da superfície do catalisador
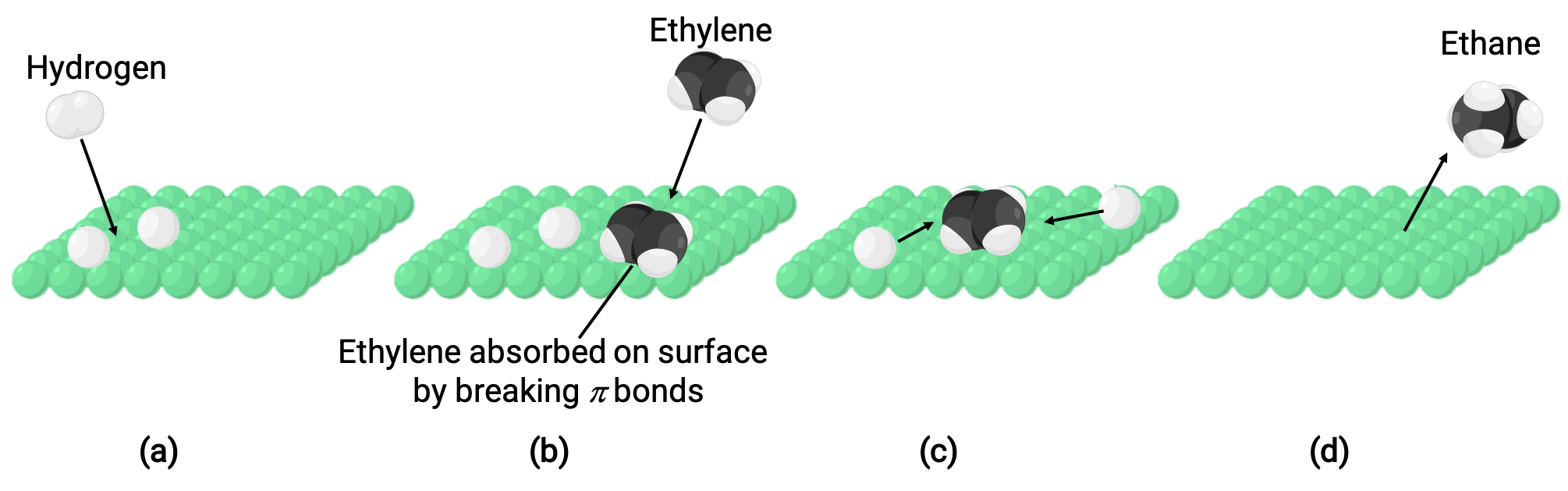
A imagem ilustrada representa o mecanismo de reação envolvendo a catálise heterogénea de eteno e hidrogénio gasosos em uma superfície sólida de níquel, formando etano gasoso (C2H4 + H2 ⟶ C2H6):
(a) O hidrogénio é adsorvido na superfície de níquel. Durante o processo, as ligações hidrogénio-hidrogénio são quebradas para formar ligações níquel-hidrogénio.
(b) O eteno é também adsorvido na superfície do níquel quebrando a ligação pi carbono-carbono e formando ligações níquel–carbono.
(c) Os átomos de hidrogénio difundem-se pela superfície e formam novas ligações carbono-hidrogénio quando colidem para formar etano (C2H6).
(d) As moléculas de etano sofrem dessorção da superfície do níquel.
A catálise heterogénea é usada para fabricar industrialmente produtos químicos como amoníaco, ácido nítrico, ácido sulfúrico, e metanol. Catalisadores heterogéneos também são usados nos conversores catalíticos encontrados na maioria dos automóveis movidos a gasolina.
Este texto é adaptado de Openstax, Chemistry 2e, Section 12.7: Catalysis.
