14.1:
動的平衡
14.1:
動的平衡
可逆的な化学反応とは、順方向(左から右)と逆方向(右から左)の両方に進行する化学プロセスのことです。順方向と逆方向の反応の速度が等しい場合、反応種と生成種の濃度は時間の経過とともに一定になり、系は平衡状態に達します。特別な二重矢印は、このような反応の可逆性を強調するために使用されます。平衡系における反応物と生成物の相対的な濃度は大きく異なり、平衡状態でほとんどが生成物である系もあれば、ほとんどが反応物である系もあり、かなりの量の両方が含まれる系もあります。
化学反応における動的平衡
無色の四酸化二窒素が可逆的に分解されて茶色の二酸化窒素を生成する反応は、次の式で表されます。
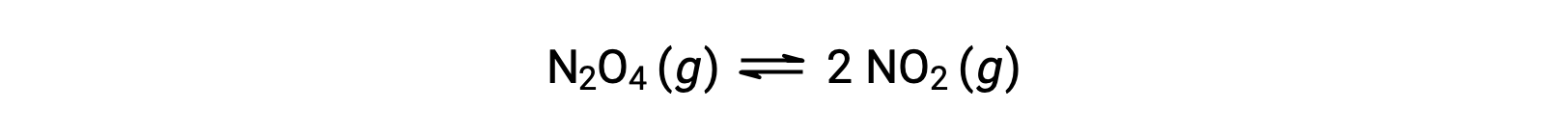
反応が始まると(time = 0)、反応物であるN2O4の濃度は有限であり、生成物であるNO2の濃度は0であるため、順方向の反応は有限の速度で進行し、逆方向の反応速度は0です。時間が経過すると、N2O4が消費されてその濃度が下がり、NO2が生成されてその濃度が上がります。反応物の濃度が下がると順方向の反応速度が遅くなり、生成物の濃度が上がると逆方向の反応速度が速くなります。このプロセスは、順方向の反応速度と逆方向の反応速度が等しくなるまで続き、その時点で反応は平衡状態に達します。ここで重要なのは、化学平衡は動的なものであるということです。平衡状態にある反応は止まっているわけではなく、順方向と逆方向に同じ速度で進行しています。したがって、平衡状態では、NO2の生成速度とNO2の消費速度が完全に等しく、N2の生成速度とN2O4の消費速度が完全に等しいため、N2とNO2の濃度は変化しません。
均一系と不均一系における平衡状態
均一系における平衡とは、以下の例に示すように、すべての反応物と生成物(および該当する場合は触媒)が液相または気相のいずれかの同一相に存在する状態をいいます。
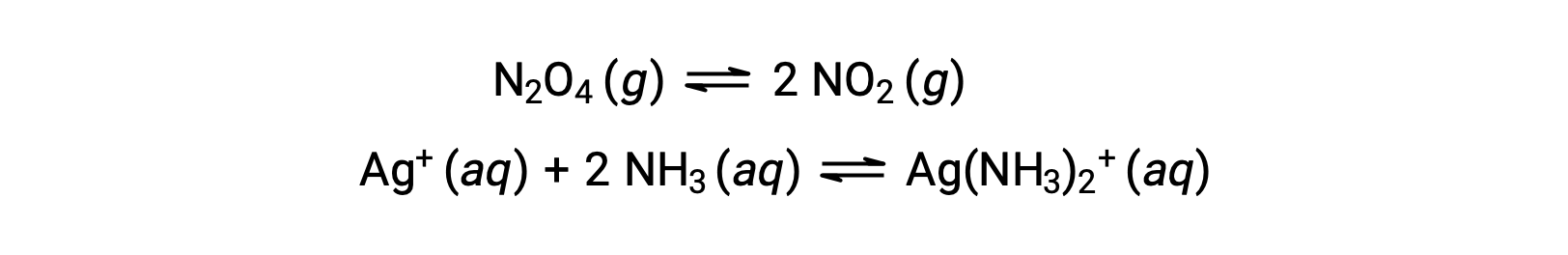
不均一系における平衡とは、以下の例で示すように、2つ以上の異なる相にある反応物と生成物を含むものです。
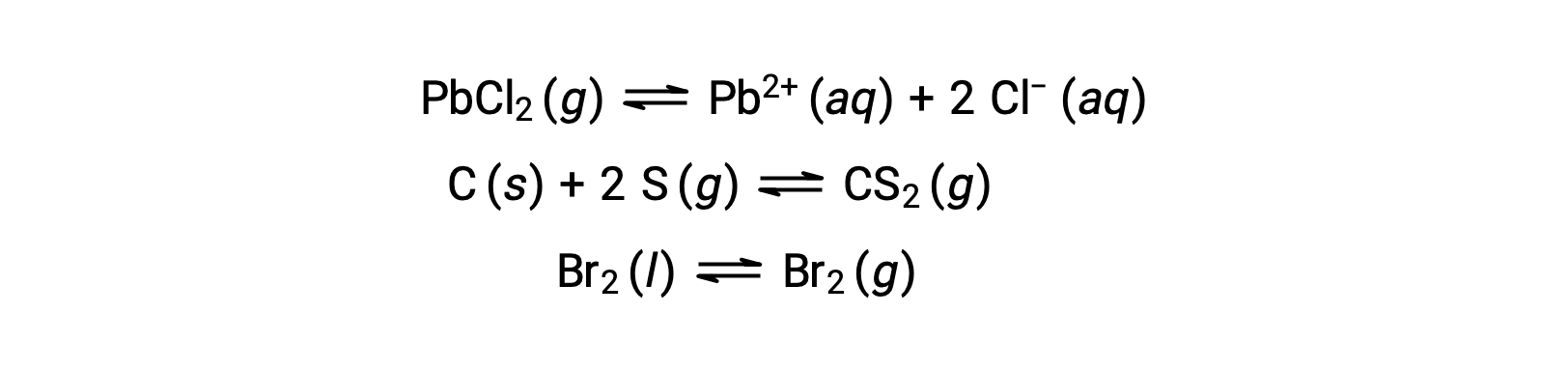
上記の文章は以下から引用しました。 Openstax, Chemistry 2e, Section 13.1 Chemical Equilibria.
