14.1:
Equilibrio Dinámico
14.1:
Equilibrio Dinámico
Una reacción química reversible representa un proceso químico que procede tanto en dirección de avance (de izquierda a derecha) como de retroceso (de derecha a izquierda). Cuando las velocidades de las reacciones hacia delante y hacia atrás son iguales, las concentraciones de las especies de reactivos y productos permanecen constantes con el tiempo y el sistema está en equilibrio. Se utiliza una flecha doble especial para enfatizar la naturaleza reversible de la reacción. Las concentraciones relativas de reactivos y productos en los sistemas en equilibrio varían enormemente; algunos sistemas contienen principalmente productos en equilibrio, algunos contienen principalmente reactivos y otros contienen cantidades apreciables de ambos.
El equilibrio dinámico en las reacciones químicas
Considere la descomposición reversible del tetroxido de dinitrógeno incoloro para producir dióxido de nitrógeno marrón, descrito por la ecuación:
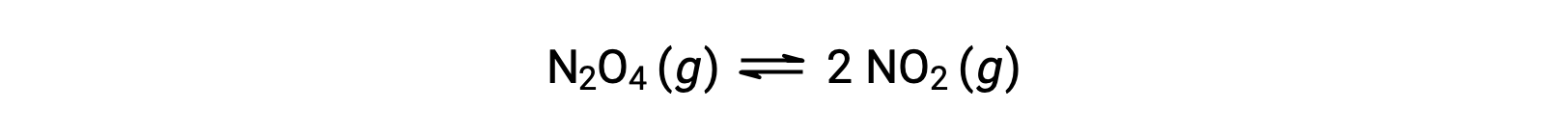
A medida que comienza la reacción (tiempo = 0), la concentración del reactivo N2O4 es finita y la del producto NO2 es cero, por lo que la reacción directa procede a una velocidad finita mientras que la velocidad de reacción inversa es cero. A medida que pasa el tiempo, se consume el N2O4 y su concentración disminuye, mientras que se produce NO2, y su concentración aumenta. La disminución de la concentración del reactivo ralentiza la velocidad de reacción hacia delante y la creciente concentración del producto acelera la velocidad de reacción hacia atrás. Este proceso continúa hasta que las velocidades de reacción hacia delante y hacia atrás se igualan, momento en el que la reacción ha alcanzado el equilibrio. Es importante enfatizar que los equilibrios químicos son dinámicos; una reacción en equilibrio no se “ha detenido”, pero está avanzando en las direcciones hacia adelante y hacia atrás al mismo ritmo. Así, en equilibrio, las concentraciones de N2O4 y de NO2 ya no cambian porque la velocidad de formación de NO2 es exactamente igual a la velocidad de consumo de NO2, y la velocidad de formación de N2O4 es exactamente igual a la tasa de consumo de N2O4.
Equilibrios homogéneos y heterogéneos
Un equilibrio homogéneo es aquel en el que todos los reactivos y productos (y cualquier catalizador, si procede) están presentes en la misma fase, ya sea acuosa o gaseosa, como se ilustra en los siguientes ejemplos:
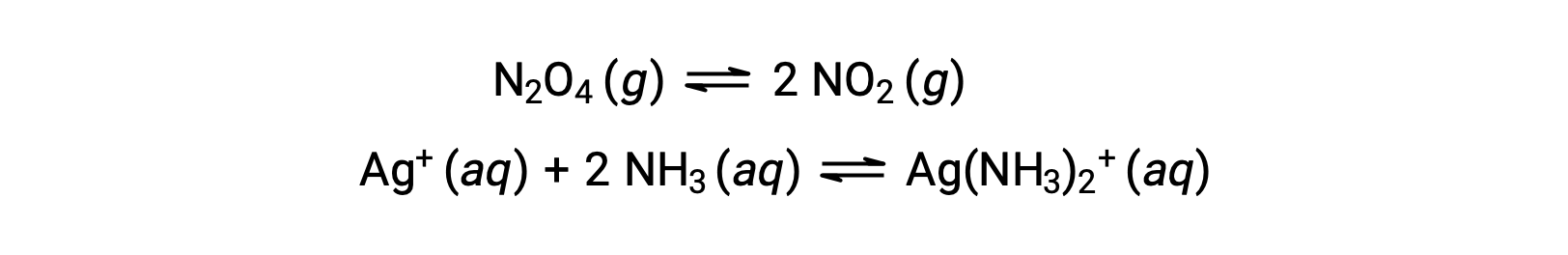
Un equilibrio heterogéneo implica reactivos y productos en dos o más fases diferentes, como se ilustra en el siguiente ejemplo:
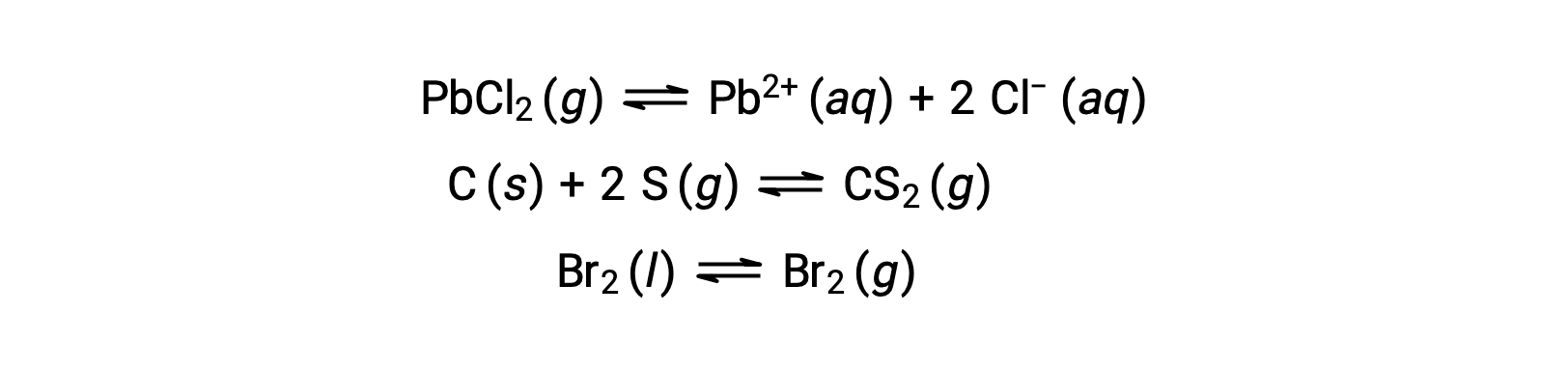
Este texto ha sido adaptado de Openstax, Química 2e, Sección 13.1 Equilibrio químico.
