14.1:
Équilibre dynamique
14.1:
Équilibre dynamique
Une réaction chimique réversible représente un processus chimique qui se déroule à la fois dans les sens direct (de gauche à droite) et inverse (de droite à gauche). Lorsque les vitesses des réactions directes et inverses sont égales, les concentrations des espèces de réactifs et des espèces de produits restent constantes au fil du temps et le système est à l’équilibre. Une double flèche spéciale est utilisée pour souligner la nature réversible de la réaction. Les concentrations relatives des réactifs et des produits dans les systèmes en équilibre varient considérablement ; certains systèmes contiennent principalement des produits à l’équilibre, d’autres contiennent principalement des réactifs et d’autres contiennent des quantités notables des deux.
Équilibre dynamique dans les réactions chimiques
Envisagez la décomposition réversible du tétraoxyde de diazote incolore pour produire du dioxyde d’azote brun, décrite par l’équation :
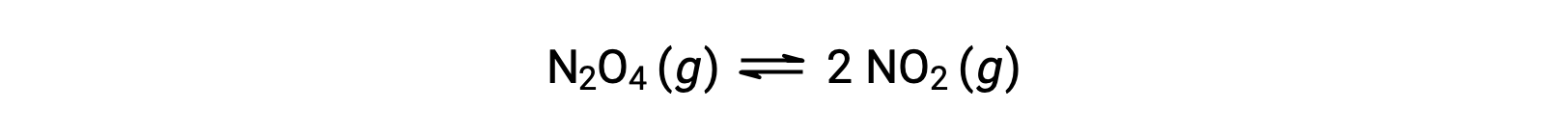
Lorsque la réaction commence (temps = 0), la concentration du réactif N2O4 est finie et celle du produit NO2 est nulle, de sorte que la réaction directe se produit à une vitesse finie alors que la vitesse de la réaction inverse est nulle. À mesure que le temps passe, N2O4 est consommé et sa concentration diminue, tandis que NO2 est produit, et sa concentration augmente. La diminution de la concentration du réactif ralentit la vitesse de la réaction directe et l’augmentation de la concentration du produit accélère la vitesse de la réaction inverse. Ce processus se poursuit jusqu’à ce que les vitesses des réactions directe et inverse deviennent égales, moment auquel la réaction a atteint l’équilibre. Il est important de souligner que les équilibres chimiques sont dynamiques ; une réaction à l’équilibre ne s’est pas “ arrêtée ”, mais elle se poursuit dans les directions directe et inverse à la même vitesse. Ainsi, à l’équilibre, les concentrations de N2O4 et de NO2 ne changent plus parce que la vitesse de formation de NO2 est exactement égale à la vitesse de consommation de NO2, et la vitesse de formation de N2O4 est exactement égale à la vitesse de consommation de N2O4.
Équilibres homogènes et hétérogènes
Un équilibre homogène est un équilibre dans lequel tous les réactifs et produits (et tous les catalyseurs, le cas échéant) sont présents dans la même phase, soit aqueuse, soit gazeuse, comme illustré par les exemples suivants :
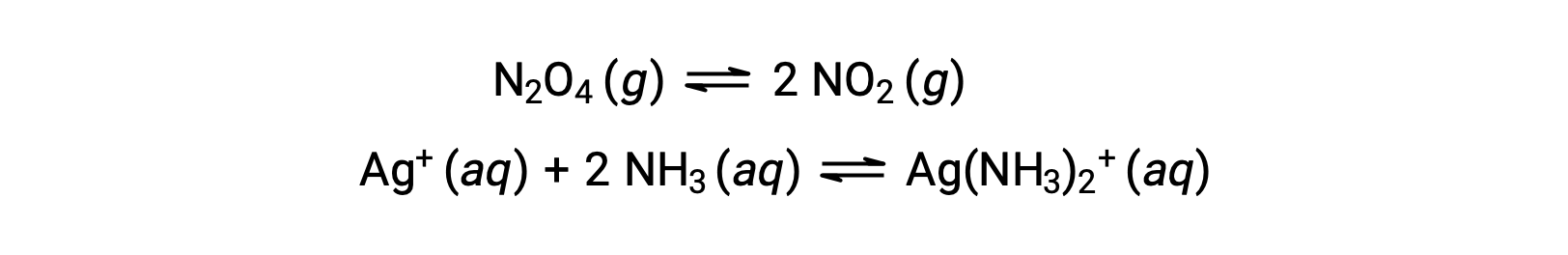
Un équilibre hétérogène implique des réactifs et des produits dans deux ou plusieurs phases différentes, comme l’illustre l’exemple suivant :
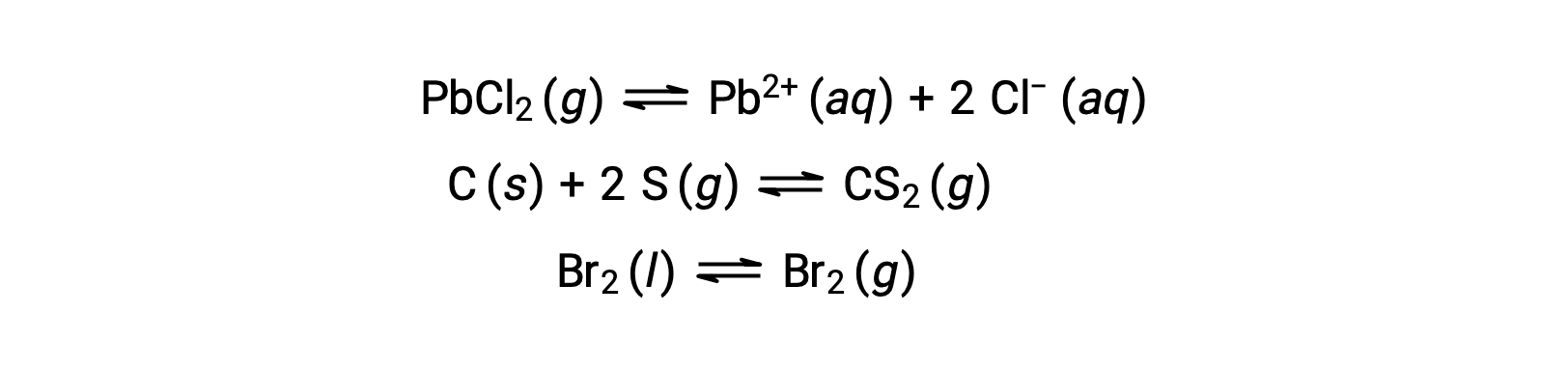
Ce texte a été adapté d’Openstax, Chimie 2e, Section 13.1 Équilibre chimique.
