14.1:
动态平衡
A subscription to JoVE is required to view this content. Sign in or start your free trial.
JoVE Core
Chemistry
Dynamic Equilibrium
可逆的化学反应是 反应物转化为产物 和产物再转化回反应物 同时发生的反应。反应物和产物之间的双箭头 表示其可逆的性质。当产物的生成速率 或正向反应速率,等于反应物的生成速率 或逆向反应速率时,则达到化学平衡。化学平衡实际上是一个动态过程。从外面看,整个系统似乎是静态的—然而,在分子水平上,它是高度活跃的。考虑一下五氯化磷的 热分解。当在一个封闭容器中加热时,气态的五氯化磷在一个可逆反应中 分解成三氯化磷和氯气 气体的混合物。随着反应的进行,五氯化磷的浓度降低,而三氯化磷和氯气的浓度增加。结果,正向反应速率 减小,而逆向反应速率增大。最终,正向反应和逆向反应的速率 变得相等,系统就达到化学平衡。在这种状态下,五氯化磷、三氯化磷和氯气的 相对浓度不再变化。这样的一种平衡状态也被称为动态平衡,因为正向反应和逆向反应 继续发生,但速率相同。由于反应物和产物的形成速率与 消耗速率相同,因此它们的浓度 保持不变,尽管不一定相等。如果在一个给定的可逆反应中,所有的 反应物和产物都处于同一相 不论是气态还是水相,则化学平衡是均相的。在非均相平衡中,反应物和产物 以不同的相存在。
14.1:
动态平衡
可逆化学反应是指正向 (从左到右) 和反向 (从右到左) 方向进行的化学过程。 当正向和反向反应的速率相等时,反应物和生成物物种的浓度随着时间的推移保持不变,系统处于平衡状态。 使用特殊的双箭头来强调反应的可反转性。 平衡系统中的反应物和生成物的相对浓度差异很大;有些系统中大部分是平衡状态下的生成物,有些系统中大部分是反应物,有些系统中两者的浓度都相当可观。
化学反应中的动态平衡
考虑无色二氧化三丁二烯二氧化氮可逆分解为产率棕色二氧化氮,如方程所述:
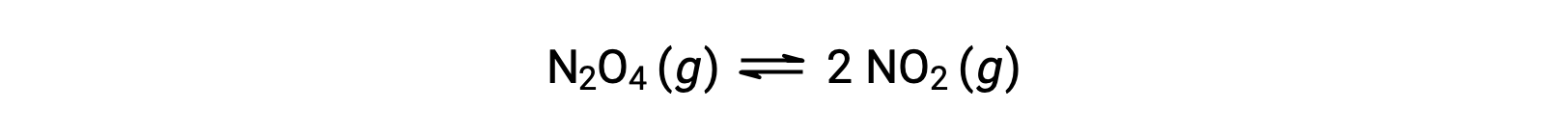
当反应开始时 (时间 = 0) , N2O4 反应物的浓度是有限的, NO2 生成物的率值是零,因此正向反应在有限的率值下进行,而反向反应 是零。 随着时间的推移, N2O4 被消耗,其浓度下降, NO2 被生产,其浓度增加。 反应物的浓度越低,正向反应率值就越慢,而生成物浓度越高,反向反应率值就越快。 这一过程一直持续到正向和反向反应速度相等,此时反应已达到平衡。 必须强调的是,化学平衡是动态的;平衡的反应并没有“停止”,但它在同一个率值上正向和反向进行。 因此,在平衡状态下, N2O4 和 NO2 的浓度不再发生变化,因为 NO2 形成的率值与 NO2 消费的率值完全相同,而N2O4形成的率值与N2O4消费的率值完全相同。
均质和异质的平衡
均质平衡是指所有反应物和生成物 (以及任何催化剂,如果适用) 均存在于相同相位 (水相或气相) 中,如下例所示:
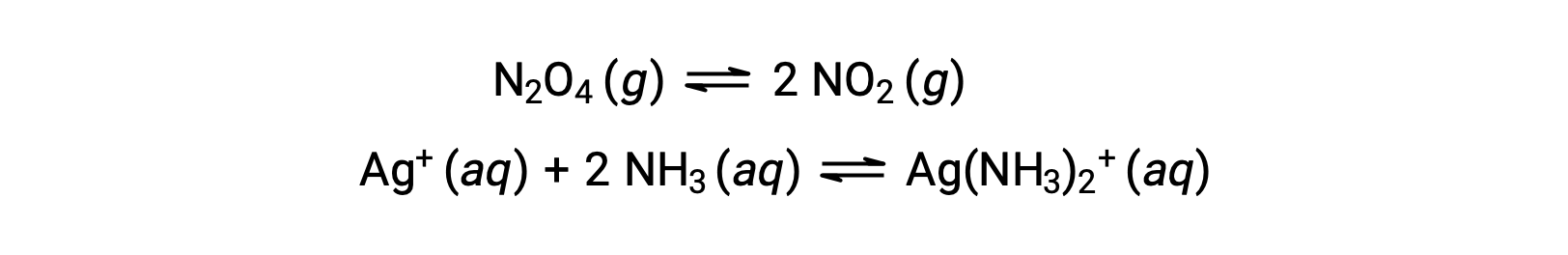
异构平衡涉及两个或多个不同阶段的反应物和生成物,如下例所示:
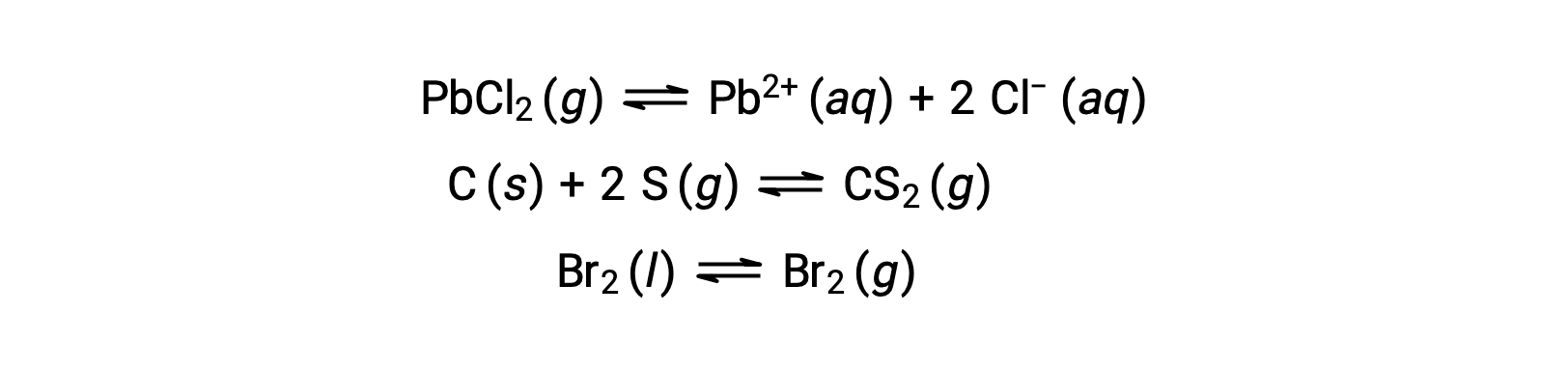
本文改编自 Openstax, 化学 2e, 第13.1节:化学平衡。
