14.2:
ثابت التوازن
14.2:
ثابت التوازن
ضع في اعتبارك أكسدة ثاني أكسيد الكبريت:
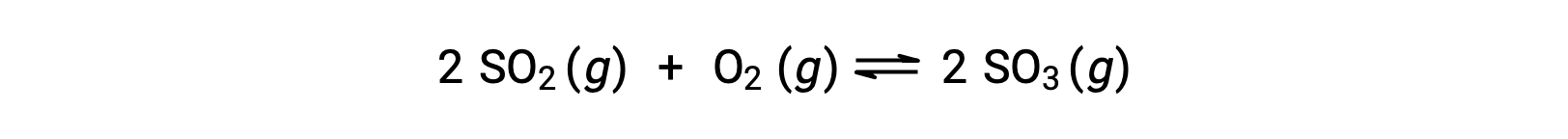
بالنسبة للتفاعل الذي يبدأ بخليط من المواد المتفاعلة فقط، يكون تركيز المنتج مبدئيًا مساويًا للصفر. مع تقدم التفاعل نحو التوازن في الاتجاه الأمامي، تنخفض تركيزات المادة المتفاعلة ويزداد تركيز المنتج. عند تحقيق التوازن ، تظل تركيزات المواد المتفاعلة والنواتج ثابتة.
إذا بدأ التفاعل مع المنتجات الموجودة فقط ، يتقدم التفاعل نحو التوازن في الاتجاه العكسي. يتناقص تركيز المنتج بمرور الوقت وتزداد تركيزات المادة المتفاعلة حتى تصبح التركيزات ثابتة عند التوازن.
ينص قانون تأثير الكتلة على أن نسبة تركيز المنتجات إلى تركيز المواد المتفاعلة عند التوازن ، والتي تم رفعها إلى معاملاتها المتكافئة ذات الصلة ، تساوي ثابتًا يسمى ثابت التوازن ،K أو Kc.
وهكذا، فإن التعبير الثابت للتوازن للتفاعل أعلاه مكتوب على النحو التالي:
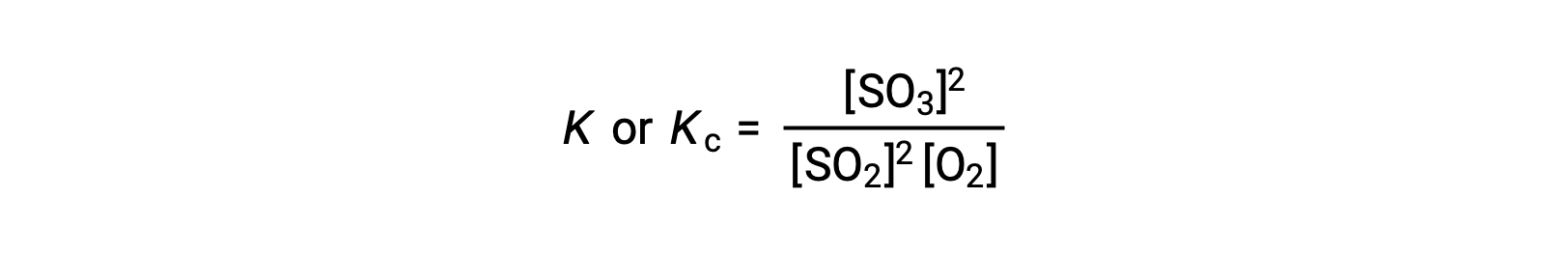
حيث أن، الرمز السفلي ‘c’ يشير إلى أن ثابت التوازن يأخذ في الاعتبار التركيز المولي للمواد المتفاعلة والمنتجات.
يعكس مقدار ثابت التوازن بشكل صريح تكوين خليط التفاعل عند التوازن. سيصل التفاعل الذي يظهر K كبير إلى التوازن عندما يتم تحويل معظم المادة المتفاعلة إلى منتج ، بينما يشير K الصغير إلى أن التفاعل يحقق التوازن بعد تحويل القليل جدًا من المادة المتفاعلة . من’ المهم أن تضع في اعتبارك أن حجم Kلا يشير إلى مدى سرعة أو بطء الوصول إلى التوازن. يتم إنشاء بعض التوازنات بسرعة بحيث تكون فورية تقريبًا ، والبعض الآخر ببطء شديد بحيث لا يتم ملاحظة أي تغيير محسوس على مدار أيام أو سنوات أو أطول. يمكن استخدام ثابت التوازن للتفاعل للتنبؤ بسلوك المخاليط التي تحتوي على المواد المتفاعلة و / أو المنتجات. كما يتضح من عملية أكسدة ثاني أكسيد الكبريت الموصوفة أعلاه ، فإن التفاعل الكيميائي سيستمر في أي اتجاه ضروري لتحقيق التوازن.
التوازن المزدوج
تشتمل العديد من أنظمة التوازن على اثنين أو أكثر من تفاعلات التوازن المقترنة تلك التي تشترك في نوع واحد أو أكثر من أنواع المواد المتفاعلة أو المنتجات. يمكن أن ترتبط قيمة K لنظام يتضمن توازنات مقترنة بقيم K للتفاعلات الفردية. يتم تضمين ثلاث معالجات أساسية في هذا النهج، كما هو موضح أدناه:
•يؤدي تغيير اتجاه المعادلة الكيميائية أساسًا إلى تبديل هويات “المتفاعلات” و “المنتجات,” وهكذا فإن ثابت التوازن للمعادلة المعكوسة هو ببساطة مقلوب للمعادلة الآجلة.
• تغيير المعاملات المتكافئة في معادلة ببعض العوامل x ينتج عنه تغير أسي في ثابت التوازن بنفس العامل.
• إضافة معادلتين أو أكثر من معادلات التوازن معًا ينتج عنها معادلة شاملة يكون ثابت التوازن هو الناتج الرياضي للتفاعل الفردي’s K قيم.
تعبير ثابت للتوازن غير المتجانس
بالنسبة إلى التوازن غير المتجانس ، الذي يتضمن المواد المتفاعلة والمنتجات في مرحلتين مختلفتين أو أكثر، لا يتم تضمين تركيزات المواد الصلبة النقية أو السوائل النقية في التعبير الثابت للتوازن ، كما هو موضح في المثال التالي:

وذلك لأن التركيزات النسبية للسوائل النقية والمواد الصلبة النقية تظل ثابتة أثناء التفاعل .
تم اقتباس هذا النص من Openstax, Chemistry 2e, Section 13.2 Equilibrium Constants.
