14.2:
평형상수
14.2:
평형상수
이산화황의 산화를 고려하십시오.
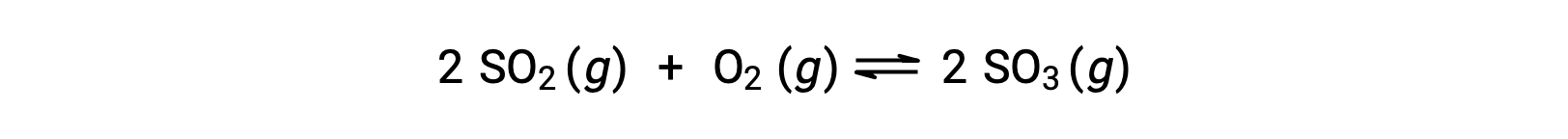
반응의 혼합물로만 시작되는 반응의 경우, 제품 농도는 처음에 0과 동일합니다. 반응이 전방 방향으로 평형을 향해 진행됨에 따라 반응농도가 감소하고 제품 농도가 증가한다. 평형이 달성되면 반응제와 제품의 농도는 일정하게 유지됩니다.
반응이 존재하는 제품으로만 시작되면, 반응은 역방향의 평형으로 진행됩니다. 제품 농도는 시간에 따라 감소하고 농도가 평형에서 일정해질 때까지 반응성 농도가 증가합니다.
질량 행동의 법칙은 각각의 stoichiometric 계수로 제기 된 평형에서 반응물질의 농도에 대한 제품의 농도의 비율이 평형 상수, K 또는 Kc라고 하는 상수와 동일하다고 명시하고있다.
따라서, 상기 반응에 대한 평형 상수 발현은 다음과 같이 기록된다.
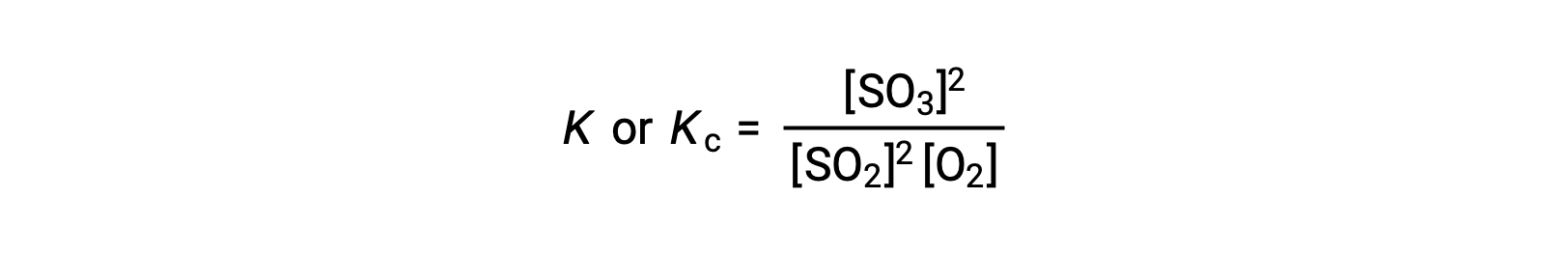
여기서, 하위 스크립트 ‘c’는 평형 상수가 반응제 및 제품의 어금니 농도를 고려한다는 것을 나타낸다.
평형 상수의 크기는 평형에서 반응 혼합물의 조성을 명시적으로 반영한다. 대형 K를 나타내는 반응은 대부분의 반응제가 제품으로 전환될 때 평형에 도달하는 반면, 작은 K는 반응이 거의 반응으로 전환된 후 평형을 달성했음을 나타낸다. K의 크기는 얼마나 신속하고 천천히 평형에 도달 할 것인지를 나타내지 않는다는 것을 명심하는 것이 중요합니다. 일부 평형은 거의 즉각적일 정도로 빨리 확립되고, 다른 평형학은 너무 느리게 확립되어 며칠, 수년 또는 그 이상 동안 지각 가능한 변화가 관찰되지 않습니다. 반응에 대한 평형 상수는 반응제 및/또는 제품을 포함하는 혼합물의 동작을 예측하는 데 사용될 수 있다. 상술한 이산화황 산화 공정에서 입증된 바와 같이, 평형을 달성하기 위해 필요한 방향으로 화학 반응이 진행됩니다.
결합 된 평형 리아
많은 평형 시스템은 두 개 이상의 결합된 평형 반응을 포함하며, 이는 공통적인 하나 이상의 반응또는 제품 종을 가지고 있습니다. 결합된 평형과 관련된 시스템의 K 값은 개별 반응의 K 값과 관련이 있을 수 있습니다. 아래 설명과 같이 세 가지 기본 조작이 이 접근 방식에 관여합니다.
• 화학 방정식의 방향을 변경하면 본질적으로 “반응제”와 “제품”의 정체성을 교환하므로 반전 된 방정식에 대한 평형 상수는 단순히 전진 방정식에 대한 상호입니다.
• 일부 요인 x에 의해 방정식에서 stoichiometric 계수를 변경하면 동일한 요인에 의해 일정한 평형의 기하급수적 변화가 발생합니다.
• 둘 이상의 평형 방정식을 함께 추가하면 평형 상수가 개별 반응의 K 값의 수학적 제품인 전체 방정식이 생성됩니다.
이기종 평형을 위한 평형 상수 발현
이질적 평형학의 경우, 2개 이상의 상이한 단계에서 반응제 및 제품을 포함하는, 순수한 고체 또는 순수 액체의 농도는 다음 예제에서 알 수 있듯이 평형 상시 발현에 포함되지 않습니다.

이는 순수한 액체와 순수 고체에 대한 상대적 농도가 반응 중에 일정하게 유지되고 있기때문이다.
