14.2: 平衡常数
考虑二氧化硫的氧化:
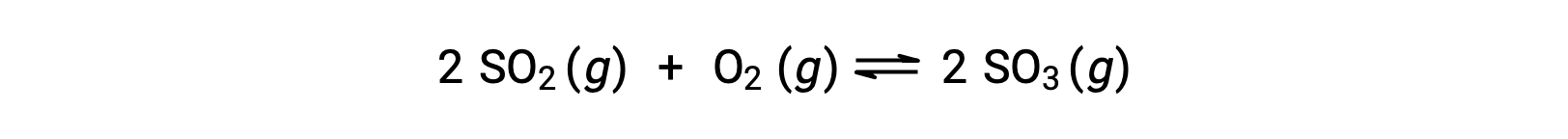
对于仅以反应物混合物开始的反应,生成物浓度最初等于零。 当反应朝着正向均衡方向前进时,反应物浓度会下降,生成物浓度会增加。 当达到平衡时,反应物和生成物的浓度保持不变。
如果反应开始时只有生成物存在,则反应将朝着相反方向逐渐达到平衡。 生成物浓度随着时间的推移而下降,反应物浓度也会增加,直到浓度在平衡状态下保持不变。
质量作用定律表示生成物,平衡状态下的浓度与反应物浓度的比值 (升高到各自的化学当量系数) 等于一个常量,称为平衡常量 K 或 KC。
因此,上述反应的平衡常量表达如下:
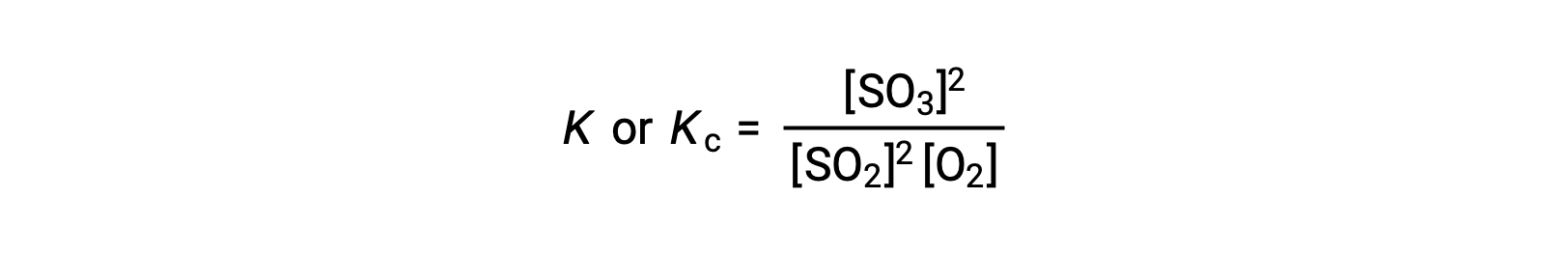
其中,下标 ‘c ’表示平衡常数考虑反应物和生成物的摩尔浓度。
平衡常数的大小明确反映了平衡时反应混合物的组成。 当大多数反应物转换为生成物时,显示较大 K 的反应将达到平衡,而较小的 K 则表示在转换极少反应物后,反应将达到平衡。 请记住, K 值的大小并不代表达到平衡的速度或速度。 一些平衡的建立速度非常快,几乎可以瞬间完成,而另一些则非常缓慢,以至于在几天,几年或更长时间内看不到明显的变化。 反应的平衡常数可用于预测含有反应物和 / 或生成物的混合物的行为。 如上文所述的二氧化硫氧化过程所示,化学反应将朝实现平衡所需的任何方向进行。
耦合平衡
许多平衡系统涉及两 种或多种耦合平衡反应,这些反应具有一种或多种常见的反应物或生成物物种。 涉及耦合平衡的系统的 K 值可以与 单个反应的 K 值相关。 这种方法涉及三个基本操作,如下所述:
•改变化学方程的方向基本上会交换“反应物”和“生成物”的特性,因此,反向方程的平衡常量只是正向方程的对等量。
• 将方程中的化学当量系数更改为 x 会 导致平衡常数在同一系数下发生指数变化。
• 将两个或多个平衡方程式相加产率一个整体方程 ,其平衡常数是单个反应 K 值的数学生成物。
异构平衡的平衡常量表达式
对于两个或多个不同相位中涉及反应物和生成物的异构平衡,纯固体或纯液体的浓度不包括在平衡常量表达中,如下例所示:

这是因为纯液体和纯固体的相对浓度在反应期间保持不变。
本文改编自 Openstax, 化学 2e, 第 13.2 节:平衡常数。


