14.2:
A Constante de Equilíbrio
14.2:
A Constante de Equilíbrio
Considere a oxidação do dióxido de enxofre:
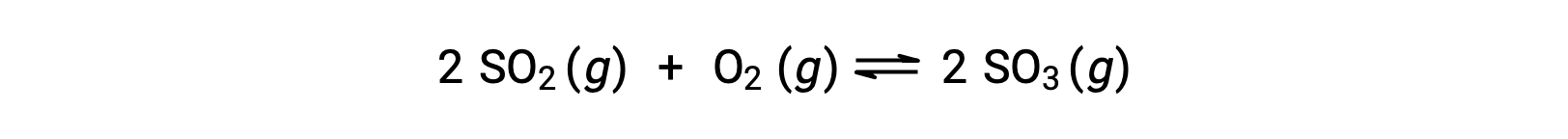
Para uma reação que começa apenas com uma mistura de reagentes, a concentração do produto é inicialmente igual a zero. À medida que a reação avança para o equilíbrio, as concentrações de reagentes diminuem e a concentração do produto aumenta. Quando o equilíbrio é alcançado, as concentrações de reagentes e produtos permanecem constantes.
Se a reação começar apenas com os produtos presentes, a reação avança para o equilíbrio na direção inversa. A concentração do produto diminui com o tempo e as concentrações de reagentes aumentam até que as concentrações se tornem constantes em equilíbrio.
A lei de ação das massas afirma que a relação entre a concentração de produtos e a concentração de reagentes em equilíbrio, elevada aos respectivos coeficientes estequiométricos, é igual a uma constante, chamada constante de equilíbrio, K ou Kc.
Assim, a expressão da constante de equilíbrio para a reação acima é escrita como:
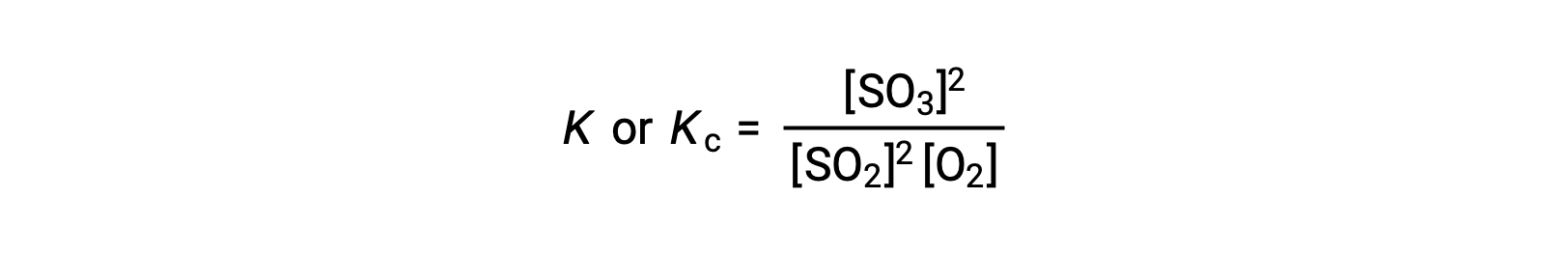
onde, o subscrito ‘c’ indica que a constante de equilíbrio considera a concentração molar de reagentes e produtos.
A magnitude da constante de equilíbrio reflete explicitamente a composição de uma mistura de reação em equilíbrio. Uma reação que exiba um K grande alcançará o equilíbrio quando a maioria dos regeantes tiver sido convertida em produto, enquanto que um K pequeno indica que a reação alcançará o equilíbrio depois de muito pouco reagente ter sido convertido. É importante ter em mente que a magnitude de K não indica o quão rapidamente ou lentamente o equilíbrio será alcançado. Alguns equilíbrios são estabelecidos tão rapidamente que são quase instantâneos, e outros tão lentamente que nenhuma mudança perceptível é observada ao longo dos dias, anos, ou mais. A constante de equilíbrio para uma reação pode ser utilizada para prever o comportamento de misturas que contenham os seus reagentes e/ou produtos. Como demonstrado pelo processo de oxidação do dióxido de enxofre descrito acima, uma reação química prosseguirá em qualquer direção que seja necessária para alcançar o equilíbrio.
Equilíbrio Acoplado
Muitos sistemas de equilíbrio envolvem duas ou mais reações de equilíbrio acoplado , aquelas que têm em comum uma ou mais espécies reagentes ou de produtos. O valor de K para um sistema que envolva equilíbrios acoplados pode estar relacionado com os valores de K das reações individuais. Três manipulações básicas estão envolvidas nesta abordagem, conforme descrito abaixo:
• A alteração da direção de uma equação química basicamente troca as identidades de “reagentes” e “produtos” e, portanto, a constante de equilíbrio para a equação inversa é simplesmente a recíproca daquela para a equação direta.
• A alteração dos coeficientes estequiométricos em uma equação por algum factor x resulta em uma mudança exponencial da constante de equilíbrio por esse mesmo factor.
• A soma de duas ou mais equações de equilíbrio gera uma equação geral cuja constante de equilíbrio é o produto matemático dos valores de K da reação individual.
Expressão da Constante de Equilíbrio para Equilíbrios Heterogéneos
Para equilíbrios heterogéneos, envolvendo reagentes e produtos em duas ou mais fases diferentes, as concentrações de sólidos puros ou líquidos puros não são incluídas na expressão da constante de equilíbrio, como ilustrado no exemplo seguinte:

Isto deve-se ao facto de as concentrações relativas de líquidos puros e sólidos puros permanecerem constantes durante a reação.
Este texto foi adaptado de Openstax, Chemistry 2e, Section 13.2 Equilibrium Constants.
