14.2:
La costante di equilibrio
14.2:
La costante di equilibrio
Considera l’ossidazione dell’anidride solforosa:
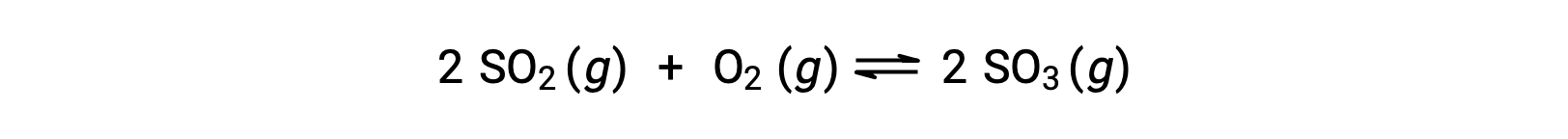
Per una reazione che inizia solo con una miscela di reagenti, la concentrazione del prodotto è inizialmente uguale a zero. Man mano che la reazione procede verso l’equilibrio nella direzione in avanti, le concentrazioni reagenti diminuiscono e la concentrazione del prodotto aumenta. Quando si raggiunge l’equilibrio, le concentrazioni di reagenti e prodotti rimangono costanti.
Se la reazione inizia solo con i prodotti presenti, la reazione procede verso l’equilibrio nella direzione inversa. La concentrazione del prodotto diminuisce con il tempo e le concentrazioni reagenti aumentano fino a quando le concentrazioni diventano costanti all’equilibrio.
La legge dell’azione di massa afferma che il rapporto tra la concentrazione dei prodotti e la concentrazione di reagenti all’equilibrio, elevato ai rispettivi coefficienti stechiometrici, è uguale a una costante, chiamata costante di equilibrio, K o Kc.
Pertanto, l’espressione costante di equilibrio per la reazione di cui sopra è scritta come:
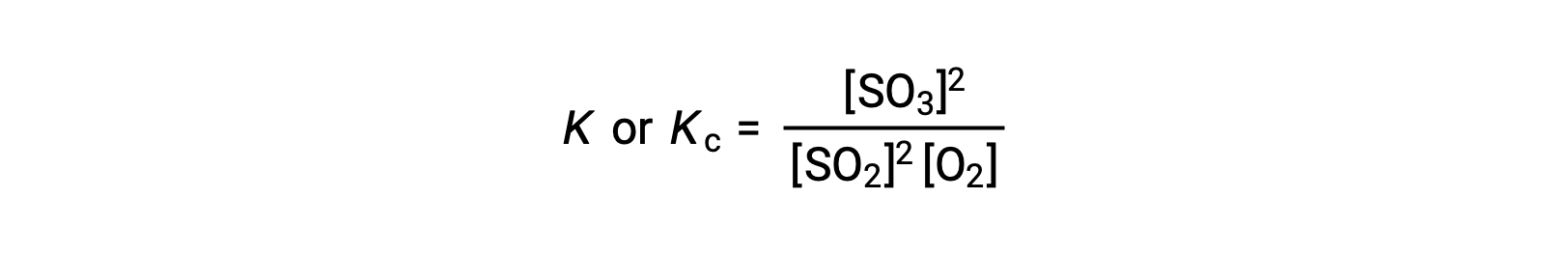
dove, il pedice ‘c’ indica che la costante di equilibrio considera la concentrazione molare di reagenti e prodotti.
La grandezza della costante di equilibrio riflette esplicitamente la composizione di una miscela di reazione all’equilibrio. Una reazione che mostra una grande K raggiungerà l’equilibrio quando la maggior parte del reagente è stata convertita in prodotto, mentre una piccola K indica che la reazione raggiunge l’equilibrio dopo che pochissimo reagente è stato convertito. È importante tenere presente che la magnitudine di K non indica quanto rapidamente o lentamente si raggiungerà l’equilibrio. Alcuni equilibri sono stabiliti così rapidamente da essere quasi istantanei, e altri così lentamente che non si osserva alcun cambiamento percepibile nel corso di giorni, anni o più. La costante di equilibrio per una reazione può essere utilizzata per prevedere il comportamento delle miscele contenenti i suoi reagenti e / o prodotti. Come dimostrato dal processo di ossidazione dell’anidride solforosa sopra descritto, una reazione chimica procederà in qualsiasi direzione sia necessaria per raggiungere l’equilibrio.
Equilibri accoppiati
Molti sistemi di equilibrio comportano due o più reazioni di equilibrio accoppiato, quelle che hanno in comune una o più specie reagenti o di prodotto. Il valore K per un sistema che coinvolge equilibri accoppiati può essere correlato ai valori K delle singole reazioni. Tre manipolazioni di base sono coinvolte in questo approccio, come descritto di seguito:
• Cambiare la direzione di un’equazione chimica scambia essenzialmente le identità di “reagenti” e “prodotti”, e quindi la costante di equilibrio per l’equazione invertita è semplicemente il reciproco di quello per l’equazione in avanti.
• La modifica dei coefficienti stechiometrici in un’equazione di qualche fattore x si traduce in un cambiamento esponenziale nella costante di equilibrio dello stesso fattore.
• Sommando due o più equazioni di equilibrio si ottiene un’equazione globale la cui costante di equilibrio è il prodotto matematico dei valori K della singola reazione.
Equilibrio Espressione costante per equilibri eterogenei
Per gli equilibri eterogenei, che coinvolgono reagenti e prodotti in due o più fasi diverse, le concentrazioni di solidi puri o liquidi puri non sono incluse nell’espressione costante di equilibrio, come illustrato dal seguente esempio:

Questo perché le concentrazioni relative per liquidi puri e solidi puri rimangono costanti durante la reazione.
Questo testo è stato adattato da Openstax, Chemistry 2e, Section 13.2 Equilibrium Constants.
