14.8:
르샤틀리에의 원리: 부피 변화 (압력 변화)
14.8:
르샤틀리에의 원리: 부피 변화 (압력 변화)
가스 상 평형의 경우, 반응제 및 제품의 농도의 변화는 변경된 부피 및 압력으로 발생할 수 있습니다. 이상적인 가스의 부분 압력 P는 어금니 농도인 M에비례합니다.

따라서 반응제 나 제품의 부분 압력의 변화는 본질적으로 농도의 변화입니다. 따라서 이러한 변화는 평형에 동일한 영향을 미칩니다. 재반응물 또는 제품을 첨가하거나 제거하는 것 외에도 가스상 평형에서 종의 압력(농도)도 시스템에 의해 점유되는 부피를 변경하여변경할 수 있다. 가스 상 평형의 모든 종은 동일한 부피를 차지하기 때문에, 부피의 주어진 변화는 반응제와 제품 모두에 대한 농도의 동일한 변화를 일으킬 것이다. 어떤 변화를 분별하기 위해, 어떤 변화가 유도할 것인지, 반응의 금식측정을 고려해야 한다.
평형에서, 반응N2 (g)+ O2 (g)⇌ 2 NO(g)반응 지수에 의해 설명

이 종의 평형 혼합물에 의해 점유된 부피가 3의 요인에 의해 감소되는 경우에, 3개의 종의 부분적인 압력은 3의 요인에 의해 증가할 것입니다:
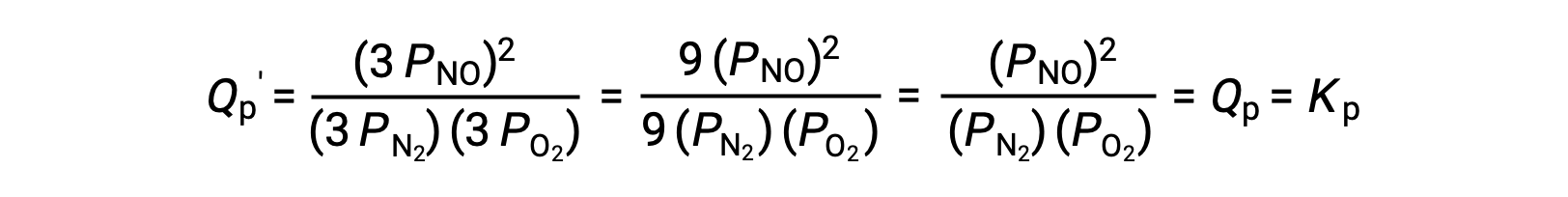
따라서, 이러한 가스상 평형 혼합물의 부피를 변경해도 평형의 변화가 발생하지 않는다.
다른 시스템의 유사한 치료, 2 SO2 (g) + O2 (g)⇌ 2 SO3 (g),그러나, 다른 결과를 산출한다:
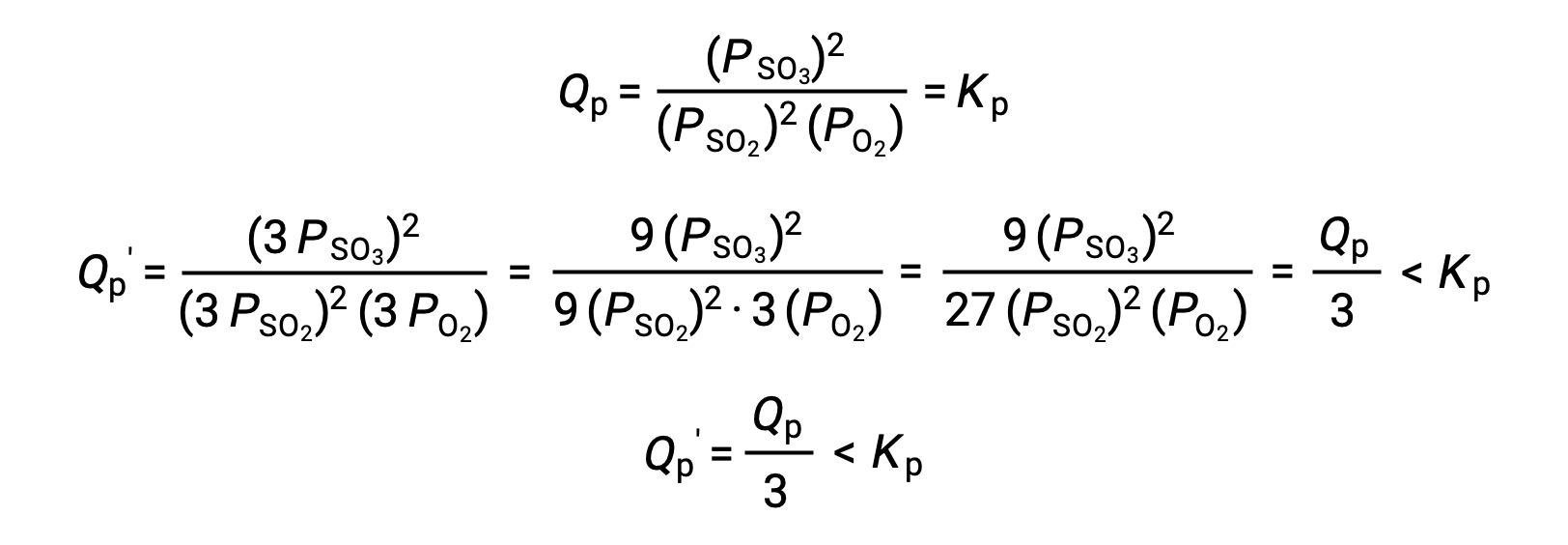
이 경우, 부피의 변화는 평형 상수보다 작게 반응 지수를 초래하고, 그래서 평형은 오른쪽으로 이동합니다.
이러한 결과는 가스 상 평형의 궤양과 부피 유도 압력(농도) 변화의 효과 사이의 관계를 보여줍니다. 첫 번째 예에서와 같이 총 어금니 량의 반응제와 제품이 같으면 부피의 변화가 평형을 이동시키지 않습니다. 어금니의 양이 다르면 볼륨의 변화가 볼륨 변경을 “수용”하는 방향으로 평형을 이동시합니다. 두 번째 예에서는, 반응제(SO 2 및O2)의 3개의 두더지가 제품의 두더지 2개를 산출하고(SO3)를산출하고, 따라서 시스템 부피를 감소시키는 것은 전방 반응이 역반응(3 mol)보다 적은 가스(2 mol)를 생성하기 때문에 평형이 오른쪽으로 이동하게 한다. 반대로, 이 평형 시스템의 볼륨을 늘리면 반응으로의 전환이 발생할 수 있습니다.
이 텍스트는 오픈 탁스, 화학 2e, 섹션 13.3 변속 평형에서 적응되었습니다 : LeChatelier의 원리.
