14.8:
Principio de le Chatelier: Cambios de Volumen (Presión)
14.8:
Principio de le Chatelier: Cambios de Volumen (Presión)
En el caso de los equilibrios de fase gaseosa, pueden producirse cambios en las concentraciones de los reactivos y productos con un volumen y una presión alterados. La presión parcial, P, de un gas ideal es proporcional a su concentración molar, M.
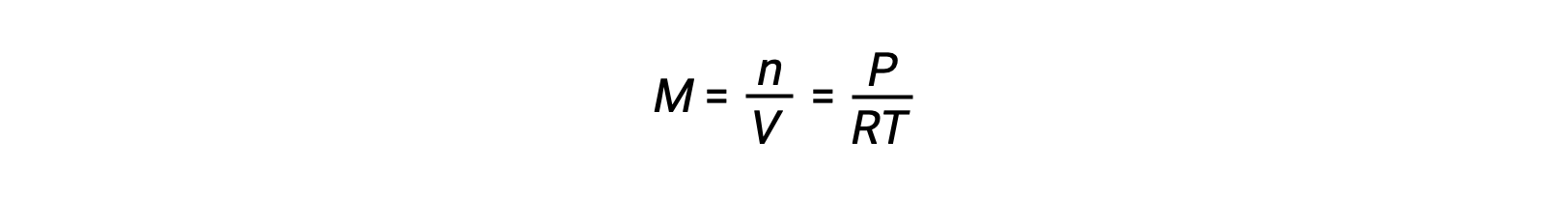
Así que, los cambios en las presiones parciales de cualquier reactivo o producto son esencialmente cambios en las concentraciones; por lo tanto, estos cambios producen los mismos efectos en los equilibrios. Además de añadir o eliminar reactivos o productos, las presiones (concentraciones) de las especies en un equilibrio de fase gaseosa también pueden cambiarse cambiando el volumen ocupado por el sistema. Dado que todas las especies de un equilibrio de fase gaseosa ocupan el mismo volumen, un cambio dado en el volumen causará el mismo cambio en la concentración tanto de los reactivos como de los productos. Para discernir qué cambio inducirá esta tensión, si hay alguno, la estequiometría de la reacción debe ser considerada.
En equilibrio, la reacción N2 (g) + O2 (g) ⇌ 2 NO (g) es descrita por el cociente de reacción
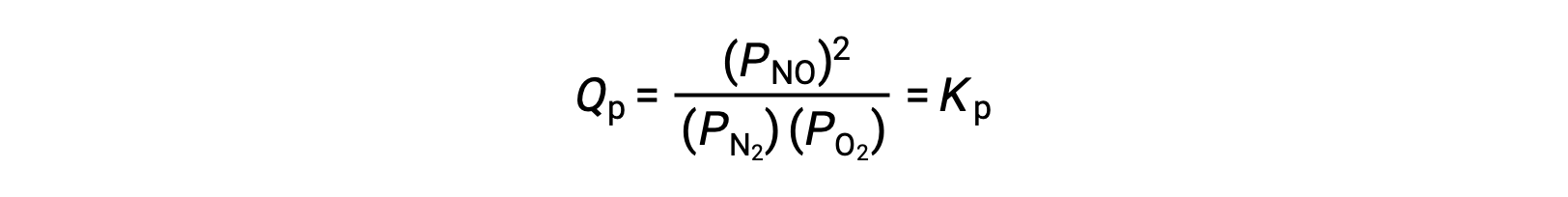
Si el volumen ocupado por una mezcla de estas especies en equilibrio se reduce en un factor de 3, las presiones parciales de las tres especies se incrementarán en un factor de 3:
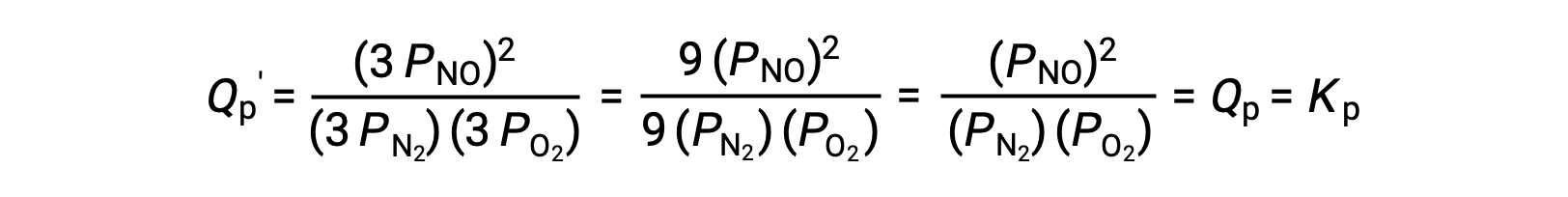
Y así, cambiar el volumen de esta mezcla de fase gaseosa en equilibrio no produce un cambio de equilibrio.
No obstante, un tratamiento similar de un sistema diferente, 2 SO2 (g) + O2 (g) ⇌ 2 SO3 (g), produce un resultado diferente:
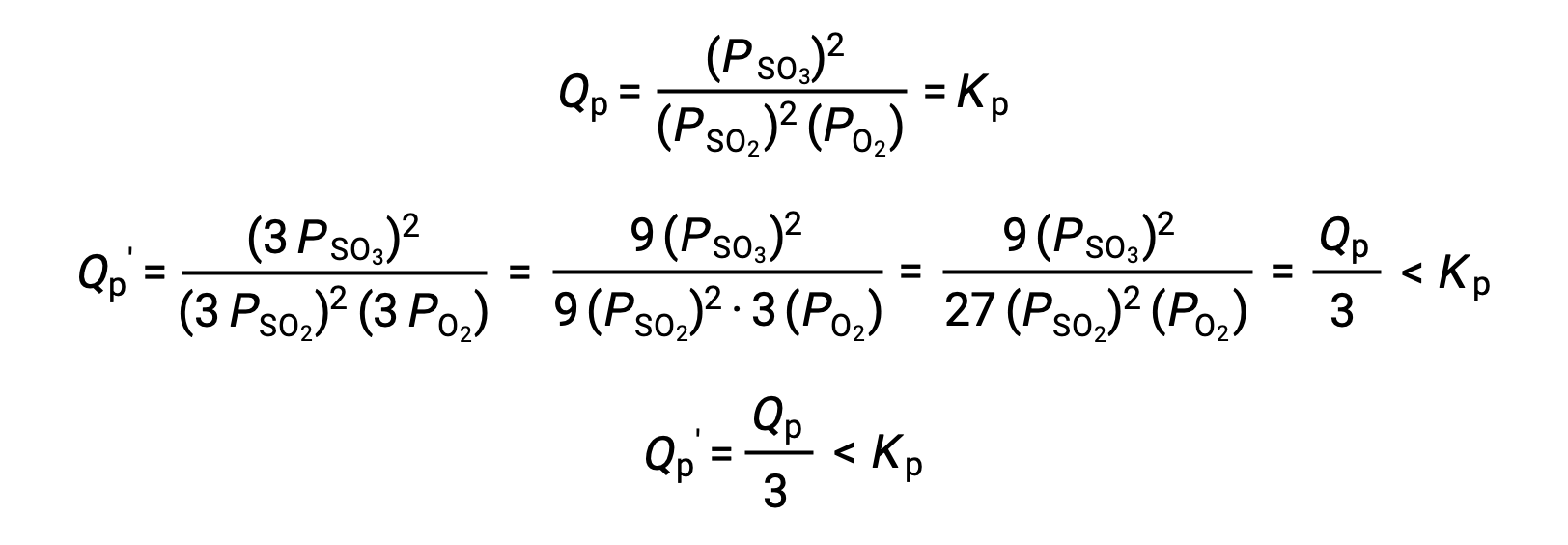
En este caso, el cambio de volumen produce un cociente de reacción menor que la constante de equilibrio, por lo que el equilibrio se desplazará hacia la derecha.
Estos resultados ilustran la relación entre la estequiometría de un equilibrio de fase gaseosa y el efecto de un cambio de presión (concentración) inducido por volumen. Si las cantidades molares totales de reactivos y productos son iguales, como en el primer ejemplo, un cambio en el volumen no cambia el equilibrio. Si las cantidades molares de reactivos y productos son diferentes, un cambio en el volumen cambiará el equilibrio en la dirección que mejor “se ajuste” al cambio de volumen. En el segundo ejemplo, tres moles de reactivo (SO2 y O2) producen dos moles de producto (SO3), y por lo tanto, la disminución del volumen del sistema hace que el equilibrio se desplace hacia la derecha, ya que la reacción de formación produce menos gas (2 mol) que la reacción de descomposición (3 mol). A la inversa, el aumento del volumen de este sistema en equilibrio daría lugar a un cambio hacia los reactantes.
Este texto ha sido adaptado de Openstax, Química 2e, Sección 13.3 Cambios en los Equilibrios: Principio de LeChatelier.
