14.8:
Principio di Le Chatelier: variazione del volume (pressione)
14.8:
Principio di Le Chatelier: variazione del volume (pressione)
Per gli equilibri gas-fase, le variazioni delle concentrazioni di reagenti e prodotti possono verificarsi con volume e pressione alterati. La pressione parziale, P, di un gas ideale è proporzionale alla sua concentrazione molare, M.

Quindi i cambiamenti nelle pressioni parziali di qualsiasi reagente o prodotto sono essenzialmente cambiamenti nelle concentrazioni; pertanto, questi cambiamenti producono gli stessi effetti sugli equilibri. Oltre ad aggiungere o rimuovere reagenti o prodotti, le pressioni (concentrazioni) delle specie in un equilibrio in fase gassosa possono anche essere modificate modificando il volume occupato dal sistema. Poiché tutte le specie di equilibrio gas-fase occupano lo stesso volume, una data variazione di volume causerà lo stesso cambiamento di concentrazione sia per i reagenti che per i prodotti. Per discernere quale spostamento, se presente, questo tipo di stress indurrà, deve essere considerata la stechiometria della reazione.
All’equilibrio, la reazione N2 (g) + O2 (g) ⇌ 2 NO (g) è descritta dal quoziente di reazione

Se il volume occupato da una miscela di equilibrio di queste specie viene diminuito di un fattore 3, le pressioni parziali di tutte e tre le specie saranno aumentate di un fattore 3:
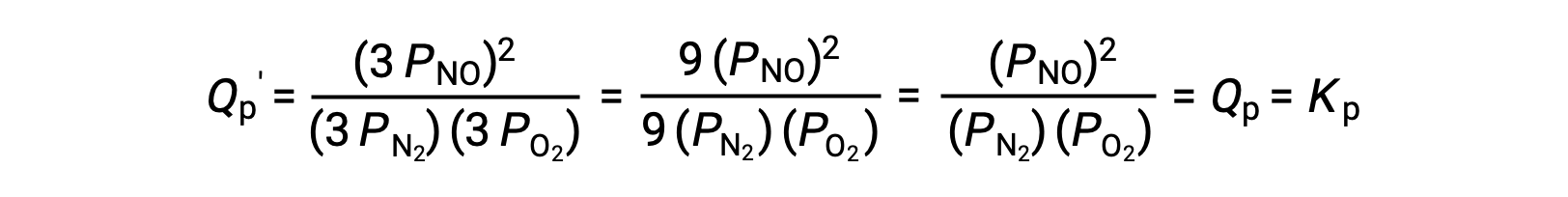
E così, cambiare il volume di questa miscela di equilibrio gas-fase non si traducono in uno spostamento dell’equilibrio.
Un trattamento analogo di un sistema diverso, 2 SO2 (g) + O2 (g) ⇌ 2 SO3 (g), tuttavia, produce un risultato diverso:
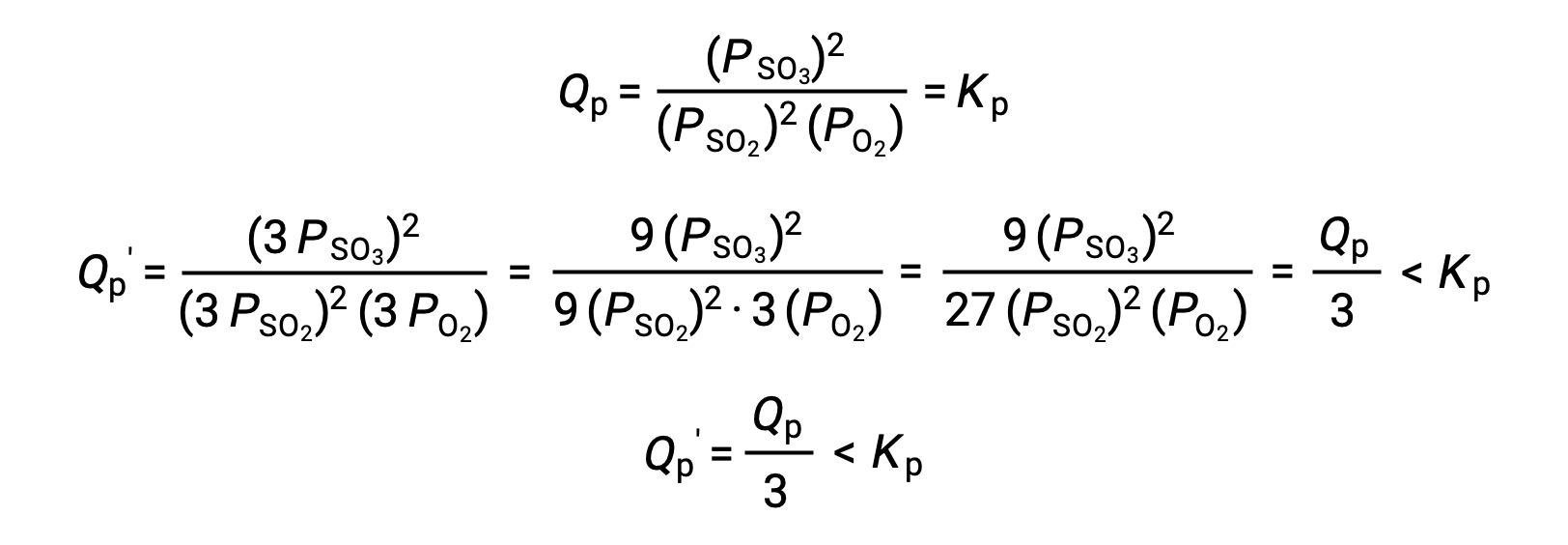
In questo caso, la variazione di volume si traduce in un quoziente di reazione più piccolo della costante di equilibrio, e quindi l’equilibrio si sposterà a destra.
Questi risultati illustrano la relazione tra la stechiometria di un equilibrio gas-fase e l’effetto di una variazione di pressione (concentrazione) indotta dal volume. Se le quantità molare totali di reagenti e prodotti sono uguali, come nel primo esempio, una variazione di volume non sposta l’equilibrio. Se le quantità molare di reagenti e prodotti sono diverse, una variazione di volume sposterà l’equilibrio in una direzione che “adatta” meglio il cambiamento di volume. Nel secondo esempio, tre talpe di reagente (SO2 e O2) producono due talpe di prodotto (SO3), e quindi diminuendo il volume del sistema l’equilibrio si sposta a destra poiché la reazione in avanti produce meno gas (2 mol) rispetto alla reazione inversa (3 mol). Al contrario, l’aumento del volume di questo sistema di equilibrio comporterebbe uno spostamento verso i reagenti.
Questo testo è stato adattato da Openstax, Chemistry 2e, Section 13.3 Shifting Equilibria: LeChatelier’s Principle.
