15.5:
Forces relatives des paires acide-base conjuguées
15.5:
Forces relatives des paires acide-base conjuguées
La chimie des acide-base de Brønsted-Lowry est le transfert de protons ; ainsi, la logique suggère une relation entre les forces relatives des couples acide-base conjugués. La force d’un acide ou d’une base est quantifiée dans sa constante d’ionisation, Ka ou Kb, qui représente l’étendue de la réaction d’ionisation de l’acide ou de la base. Pour le couple conjugué acide-base HA/A−, les équations des équilibres d’ionisation et les expressions des constantes d’ionisation sont
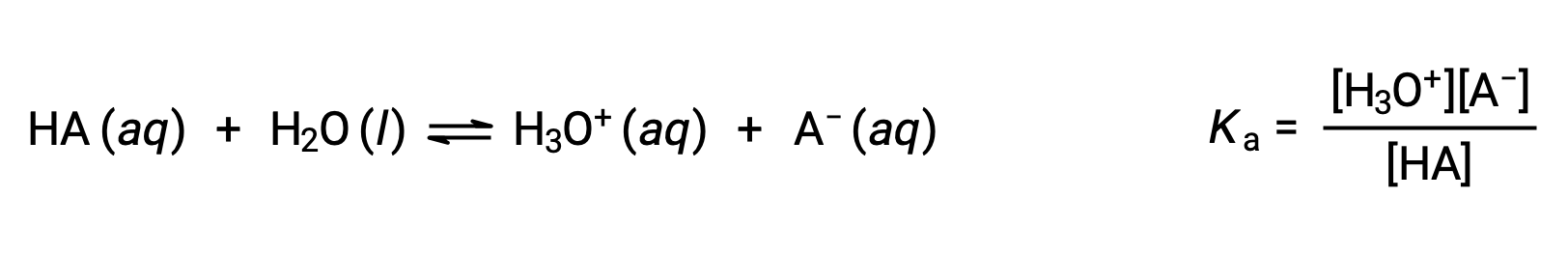
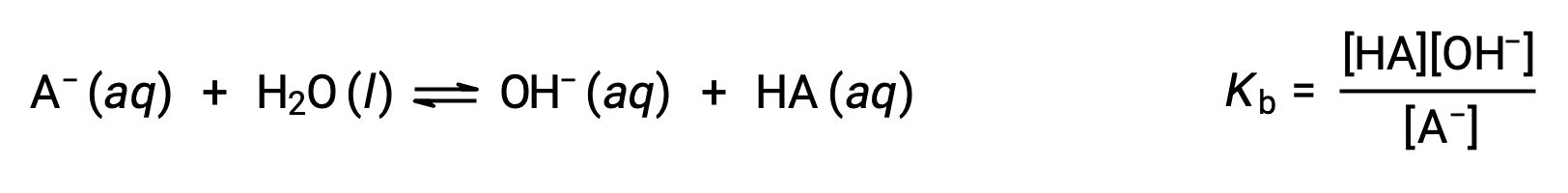
L’addition de ces deux équations chimiques conduit à l’équation de l’auto-ionisation de l’eau :
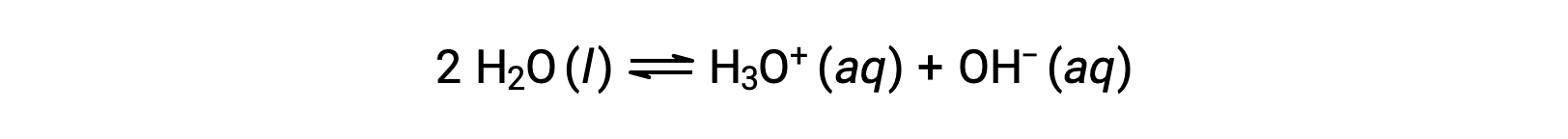
Comme nous l’avons déjà mentionné, la constante d’équilibre pour la somme des réactions est égale au produit mathématique des constantes d’équilibre pour les réactions additionnées, et ainsi de suite
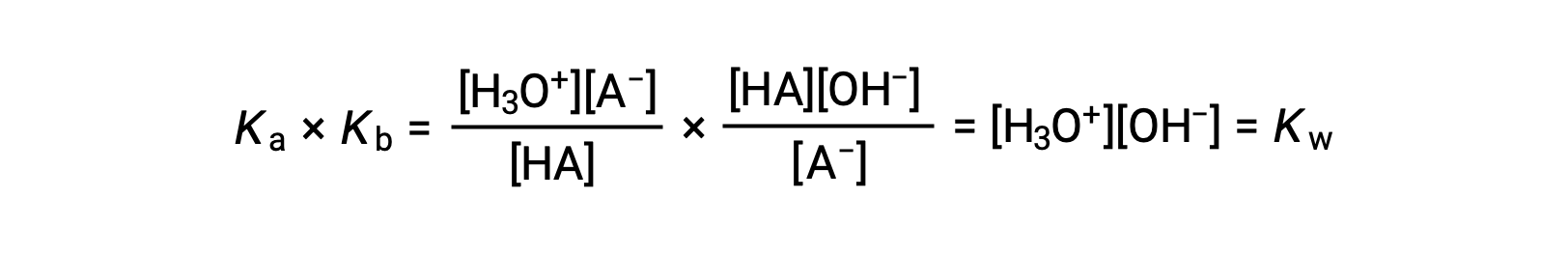
Cette équation indique la relation entre les constantes d’ionisation pour tout couple acide-base conjugué, à savoir, leur produit mathématique est égal au produit ionique de l’eau, KE. En réorganisant cette équation, une relation réciproque entre les forces d’un couple acide-base conjugué devient évidente :
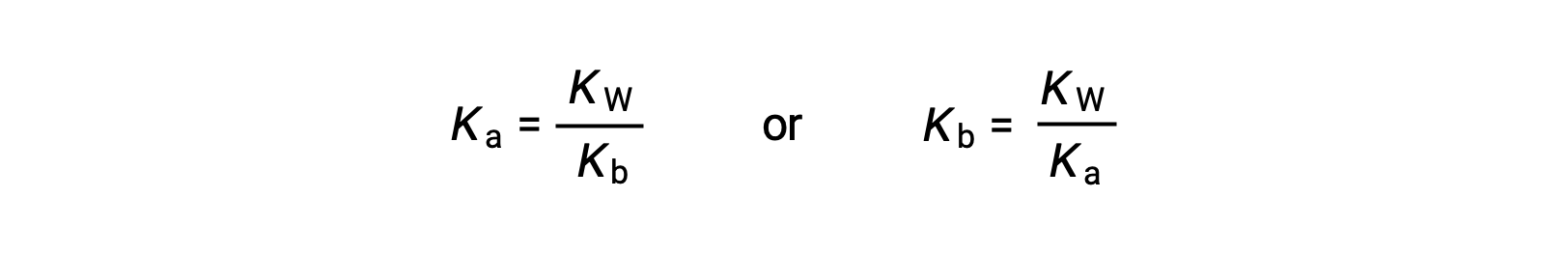
La relation inversement proportionnelle entre Ka et Kb signifie que plus l’acide ou la base est fort, plus son partenaire conjugué est faible.
En prenant le log négatif des deux côtés de l’équation, Ka × Kb = KE donne
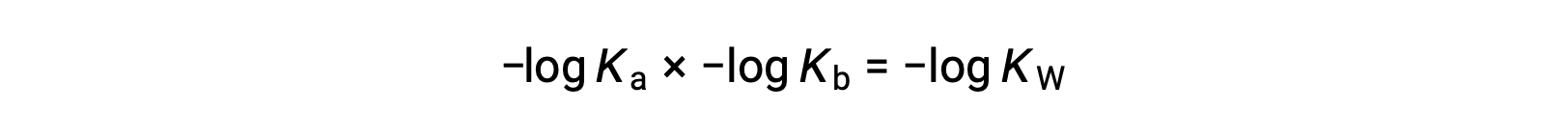
alors
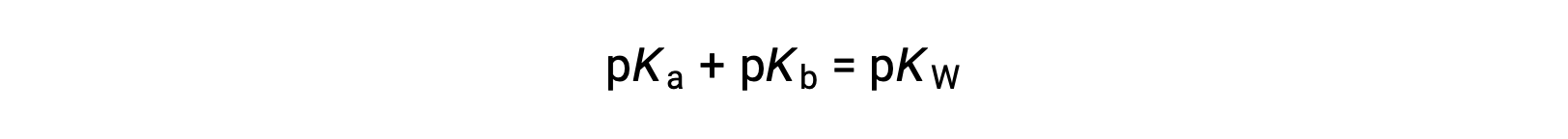
Comme le pKE est de 14 à 25 °C, cette équation peut également être écrite comme
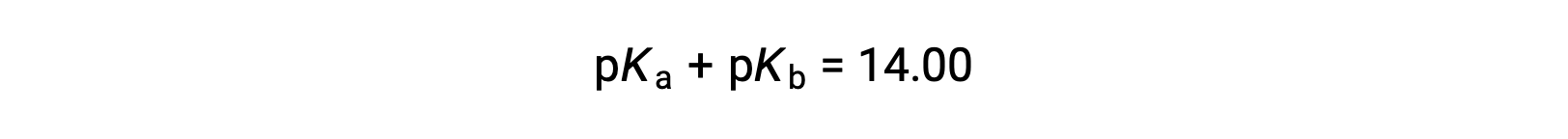
Le pKa et le pKb représentent également la force des acides et des bases, respectivement. Comme le pH et le pOH, plus la valeur de pKa ou pKb est élevée, plus l’acide ou la base est faible, respectivement.
| Acide | Base |
| Acide perchlorique (HClO4)* | Ion perchlorate (ClO4−)** |
| Acide sulfurique (H2SO4)* | Ion hydrogénosulfate (HSO4−)** |
| Iodure d’hydrogène (HI)* | Ion iodure (I−)** |
| Bromure d’hydrogène (HBr)* | Ion bromure (Br−)** |
| Chlorure d’hydrogène (HCl)* | Ion chlorure (Cl−)** |
| Acide nitrique (HNO3)* | Ion nitrate (NO3−)** |
| Ion hydronium (H3O+) | Eau (H2O) |
| Ion sulfate d’hydrogène (HSO4−) | Ion sulfate (SO42−) |
| Acide phosphorique (H3PO4) | Ion dihydrogénophosphate (H2PO4−) |
| Fluorure d’hydrogène (HF) | Ion fluorure (F−) |
| Acide nitreux (HNO2) | Ion nitrite (NO2−) |
| Acide acétique (CH3CO2H) | Ion acétate (CH3CO2−) |
| Acide carbonique (H2CO3) | Ion hydrogénocarbonate (HCO3−) |
| Sulfure d’hydrogène (H2S) | Ion hydrogénosulfure (HS−) |
| Ion ammonium (NH4+) | Ammoniac (NH3) |
| Cyanure d’hydrogène (HCN) | Ion cyanure (CN−) |
| Ion hydrogénocarbonate (HCO3−) | Ion carbonate (CO32−) |
| Eau (H2O) | Ion hydroxyde (OH−) |
| Ion hydrogénosulfure (HS−)† | Ion sulfure (S2−)‡ |
| Éthanol (C2H5OH)† | Ion éthoxyde (C2H5O−)‡ |
| Ammoniac (NH3)∔ | Ion amidure (NH2−)‡ |
| Hydrogène (H2)† | Ion hydrure (H−)‡ |
| Méthane (CH4)† | Ion méthide (CH3−)‡ |
| *subissent une ionisation totale de l’acide dans l’eau | |
| †ne subit pas d’ionisation de l’acide dans l’eau | |
| **ne subit pas d’ionisation de la base dans l’eau | |
| ‡ subissent une ionisation totale de la base dans l’eau | |
La liste des couples acide–base conjugués est organisée de façon à montrer la force relative de chaque espèce par rapport à l’eau. Dans la colonne des acides, les espèces énumérées au-dessous de l’eau sont des acides plus faibles que l’eau. Ces espèces ne subissent pas d’ionisation de l’acide dans l’eau ; ce ne sont pas des acides de Brønsted-Lowry. Toutes les espèces énumérées au-dessus de l’eau sont des acides plus forts, transférant les protons à l’eau dans une certaine mesure lorsqu’elles sont dissoutes dans une solution aqueuse pour générer des ions hydronium. Les espèces au-dessus de l’eau mais au-dessous de l’ion hydronium sont des acides faibles, soumis à une ionisation de l’acide partielle, alors que celles au-dessus de l’ion hydronium sont des acides forts qui sont complètement ionisés en solution aqueuse.
Ce texte est adapté de Openstax, Chimie 2e, Section 14.3: Forces relatives des acides et des bases.
