15.5:
Forças Relativas de Pares Ácido-Base Conjugados
15.5:
Forças Relativas de Pares Ácido-Base Conjugados
A química ácido-base de Brønsted-Lowry é a transferência de protões; assim, a lógica sugere uma relação entre as forças relativas dos pares ácido-base conjugados. A força de um ácido ou base é quantificada na sua constante de ionização, Ka ou Kb, que representa a extensão da reação de ionização ácida ou básica. Para o par ácido-base conjugado HA / A−, as equações de equilíbrio de ionização e as expressões de constantes de ionização são
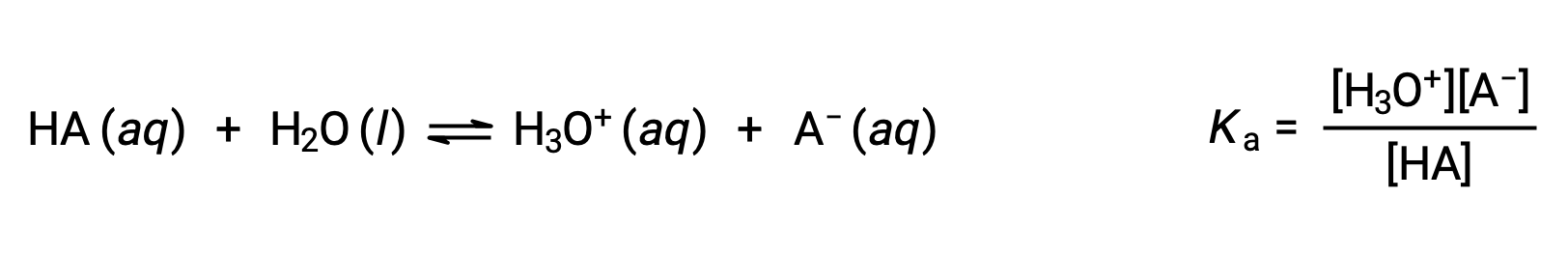
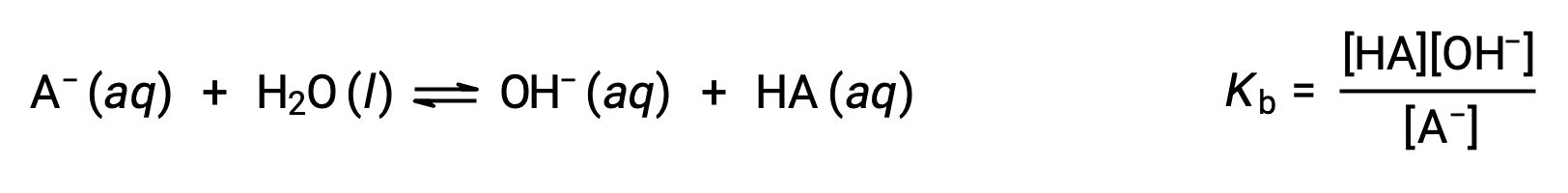
A adição destas duas equações químicas produz a equação para a autoionização da água:
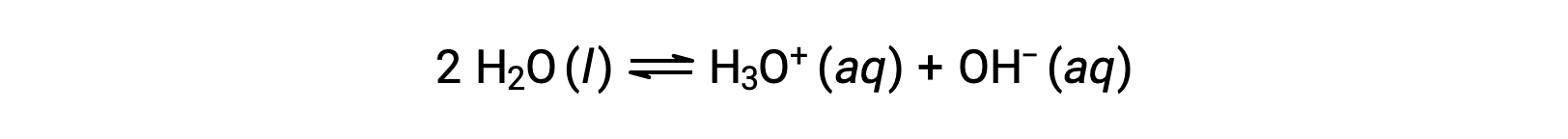
Como discutido anteriormente, a constante de equilíbrio para uma reação somada é igual ao produto matemático das constantes de equilíbrio para as reações adicionadas, e portanto
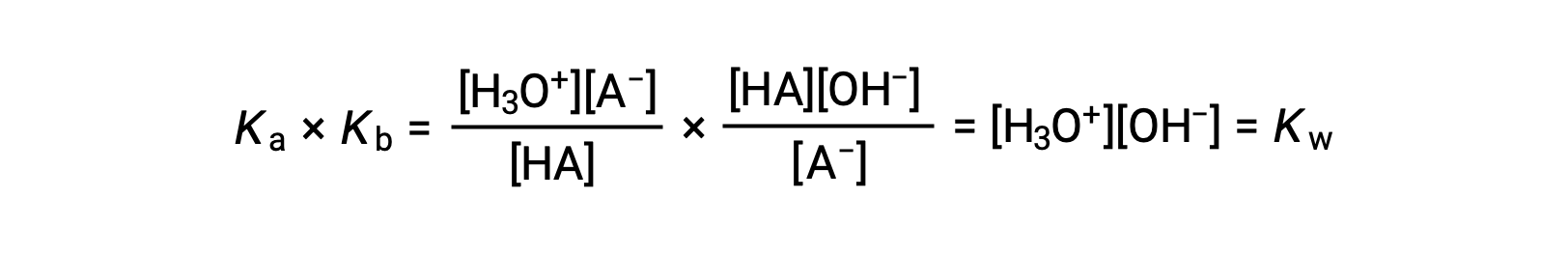
Esta equação indica a relação entre as constantes de ionização para qualquer par ácido-base conjugado, ou seja, o seu produto matemático é igual ao produto iónico da água, KW. Ao reorganizar esta equação, torna-se evidente uma relação recíproca entre as forças de um par ácido-base conjugado:
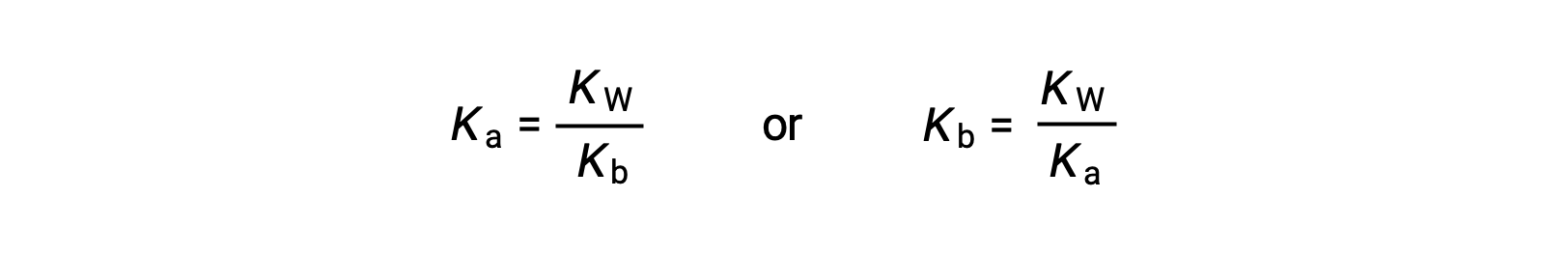
A relação proporcional inversa entre Ka e Kb significa que quanto mais forte for o ácido ou a base, mais fraco será o seu par conjugado.
Tomando o log negativo de ambos os lados da equação, Ka × Kb = KW obtemos
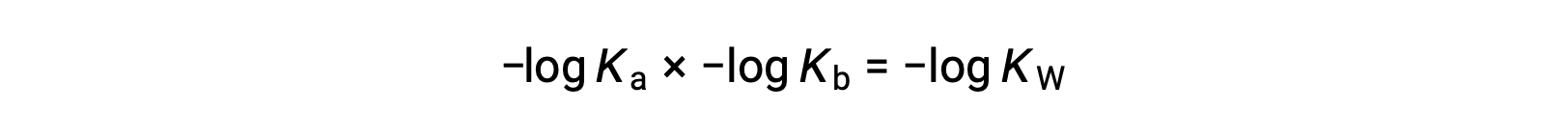
e depois
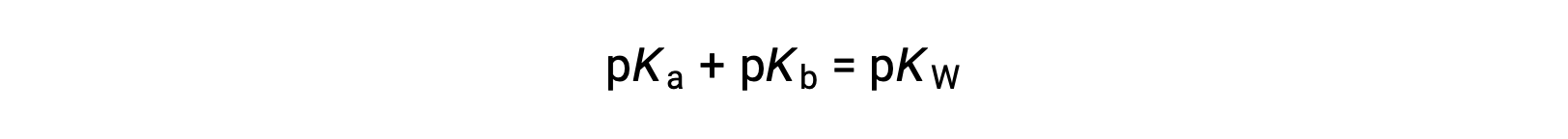
Como pKW é 14 a 25 °C, esta equação também pode ser escrita como
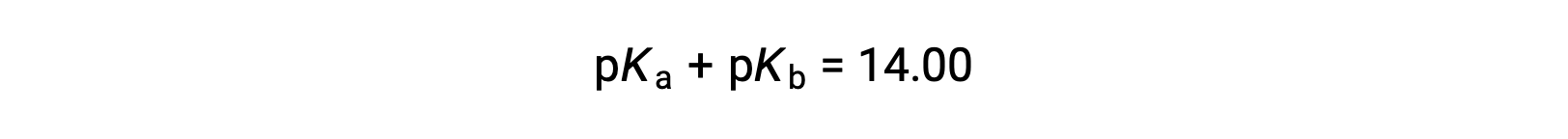
O pKa e pKb também representam a força de ácidos e bases, respectivamente. Como pH e pOH, quanto maior o valor de pKa ou pKb, mais fraco o ácido ou base, respectivamente.
| Ácido | Base |
| Ácido perclórico (HClO4)* | Ião perclorato (ClO4−)** |
| Ácido sulfúrico (H2SO4)* | Ião sulfato de hidrogénio (HSO4−)** |
| Iodeto de hidrogénio (HI)* | Ião iodeto (I−)** |
| Brometo de hidrogénio (HBr)* | Ião brometo (Br−)** |
| Cloreto de hidrogénio (HCl)* | Ião cloreto (Cl−)** |
| Ácido nítrico (HNO3)* | Ião nitrato (NO3−)** |
| Ião hidrónio (H3O+) | Água (H2O) |
| Ião sulfato de hidrogénio (HSO4−) | Ião sulfato (SO42−) |
| Ácido fosfórico (H3PO4) | Ião fosfato de dihidrogénio (H2PO4−) |
| Fluoreto de hidrogénio (HF) | Ião fluoreto (F−) |
| Ácido nitroso (HNO2) | Ião nitrito (NO2−) |
| Ácido acético (CH3CO2H) | Ião acetato (CH3CO2−) |
| Ácido carbónico (H2CO3) | Ião carbonato de hidrogénio (HCO3−) |
| Sulfeto de hidrogénio (H2S) | Ião sulfeto de hidrogénio (HS−) |
| Ião amónio (NH4+) | Amoníaco (NH3) |
| Cianeto de hidrogénio (HCN) | Ião cianeto (CN−) |
| Ião carbonato de hidrogénio (HCO3−) | Ião carbonato (CO32−) |
| Água (H2O) | Ião hidróxido (OH−) |
| Ião sulfeto de hidrogénio (HS−)† | Ião sulfeto (S2−)‡ |
| Etanol (C2H5OH)† | Ião etóxido (C2H5O−)‡ |
| Amoníaco (NH3)† | Ião amida (NH2−)‡ |
| Hidrogénio (H2)† | Ião hidreto (H−)‡ |
| Metane (CH4)† | Ião metileto (CH3−)‡ |
| *Submete-se a ionização ácida completa em água | |
| † Não se submete a ionização ácida em água | |
| **Não se submete a ionização básica em água | |
| ‡ Submete-se a ionização básica completa em água | |
A listagem dos pares de ácido-base conjugados apresentada está organizada para mostrar a força relativa de cada espécie em comparação com a água. Na coluna ácida, as espécies alistadas abaixo da água são ácidos mais fracos do que a água. Estas espécies não são submetidas a ionização ácida em água; não são ácidos de Brønsted-Lowry. Todas as espécies listadas acima da água são ácidos mais fortes, transferindo protões para a água em certa medida quando dissolvidas em solução aquosa para gerar iões hidrónio. As espécies acima da água, mas abaixo do ião hidrónio são ácidos fracos, submetidos a ionização ácida parcial, enquanto que as acima do ião hidrónio são ácidos fortes que são completamente ionizados em solução aquosa.
Este texto é adaptado de Openstax, Chemistry 2e, Section 14.3: Relative Strengths of Acids and Bases.
