16.3:
亨德森-哈塞尔巴尔赫方程(Henderson-Hasselbalch Equation)
16.3:
亨德森-哈塞尔巴尔赫方程(Henderson-Hasselbalch Equation)
弱酸的溶液的电离常数表达式可以写为:
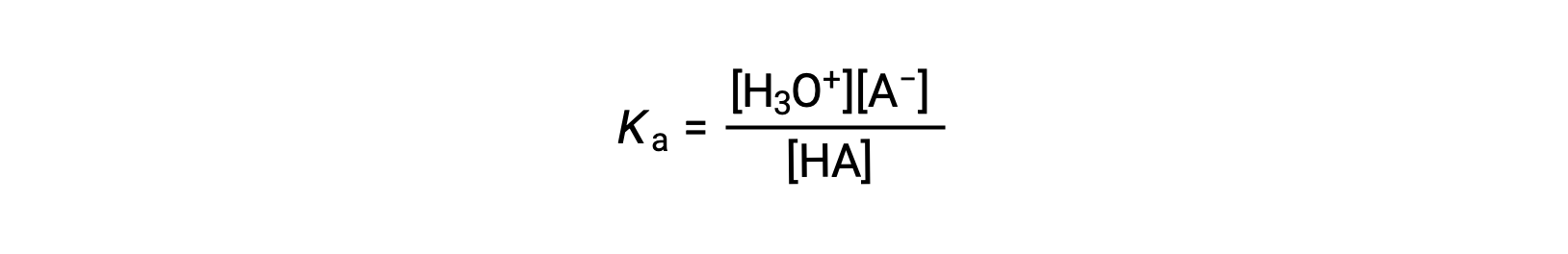
重新安排以解决 [H3O+] 的产量:
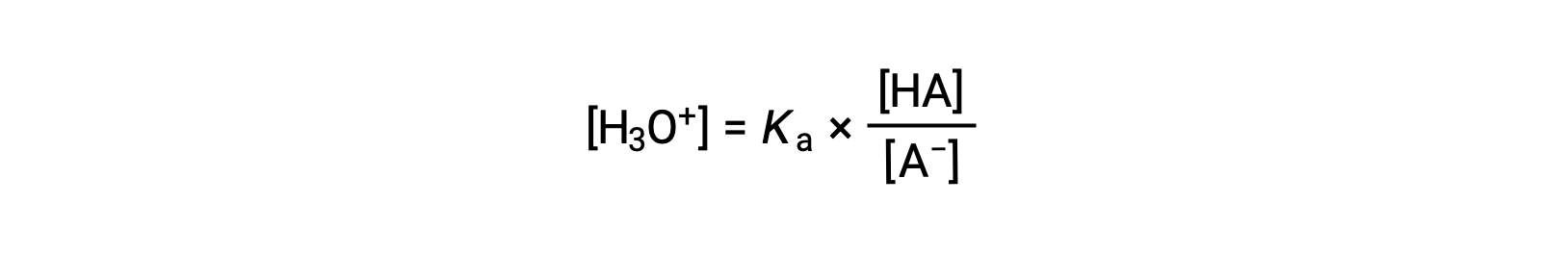
使用该方程两侧的负对数 给出
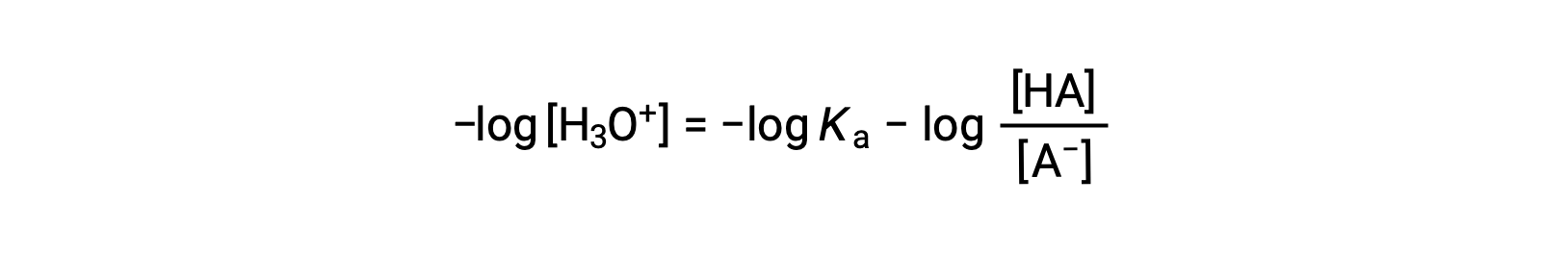
可作为写入
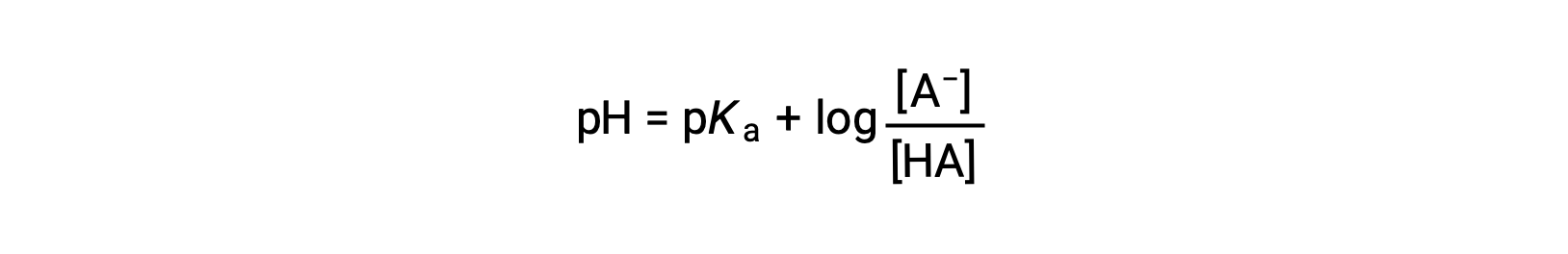
其中 pka 是弱酸电离常数对数的负 (pka = −log ka)。 该方程将 pH 值,弱酸的电离常数以及缓冲溶液中弱共轭酸碱对的浓度关联起来。 科学家经常使用这种称为 亨德森-哈塞尔巴尔赫方程(Henderson-Hasselbalch Equation) 的表达来计算缓冲溶液的 pH 值。 请注意,“ x is small ”假设必须有效才能使用此方程。
劳伦斯 · 约瑟夫 · 亨德森和 卡尔·阿尔伯特·哈塞尔巴尔(Karl Albert Hasselbalch)
劳伦斯 · 约瑟夫 · 亨德森 (1878 – 1942 年 ) 是美国生物化学家和生理学家医师,仅列举他的几项追求。 他获得了哈佛大学的医学学位,然后在斯特拉斯堡学习了两年,后来又进入了德国,然后回到哈佛大学担任讲师。 他最终成为了哈佛的教授,一生都在那里工作。 他发现人类血液中的 酸-碱 平衡由溶解血液中的二氧化碳形成的缓冲液系统调节。 1908 年,他写了一篇方程,描述血液中的碳酸二酯缓冲液系统。 亨德森知识渊博;除了他关于血液生理学的重要研究之外,他还撰写了有关生物体适应及其与环境的适应,社会学和大学教育的文章。 他还在哈佛大学商学院创办了疲劳实验室,该实验室专门研究人体生理学,重点关注工业,运动和营养方面的工作。
1916 年,丹麦医师和化学家 卡尔·阿尔伯特·哈塞尔巴尔(Karl Albert Hasselbalch) (1874 – 1962 年) 在 1904 年与 克里斯蒂安·玻尔(Christian Bohr) 分享了一份描述玻尔效应的文件, 这表明血液中的血红蛋白与氧气结合的能力与血液的酸度和二氧化碳的浓度成反比。 pH值 于 1909 年由另一名丹麦人 索伦森(Sørensen) 推出, 1912 年,哈塞尔巴尔赫发布了血液 pH 值的测量结果。 1916 年,哈塞尔巴尔赫以对数表示亨德森的方程,与 pH 的对数刻度一致,因此 亨德森-哈塞尔巴尔赫方程(Henderson-Hasselbalch Equation) 诞生了。
本文改编自 Openstax, 化学 2e, 第14.6节:缓冲液。
Suggested Reading
De Levie, Robert. "The Henderson-Hasselbalch equation: its history and limitations." Journal of Chemical Education 80, no. 2 (2003): 146. https://pubs.acs.org/doi/pdf/10.1021/ed080p146.
