16.3:
Équation de Henderson-Hasselbalch
16.3:
Équation de Henderson-Hasselbalch
L’expression de la constante d’ionisation pour une solution d’un acide faible peut être écrite comme suit :
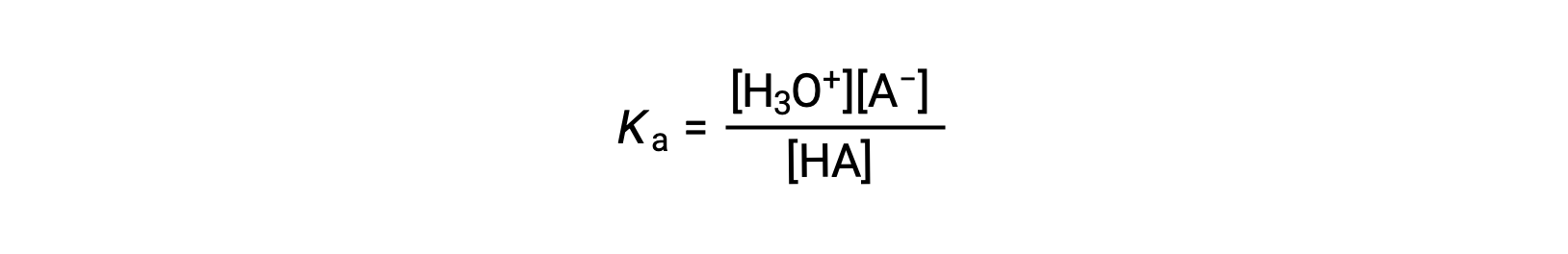
La réorganisation pour résoudre [H3O+] donne :
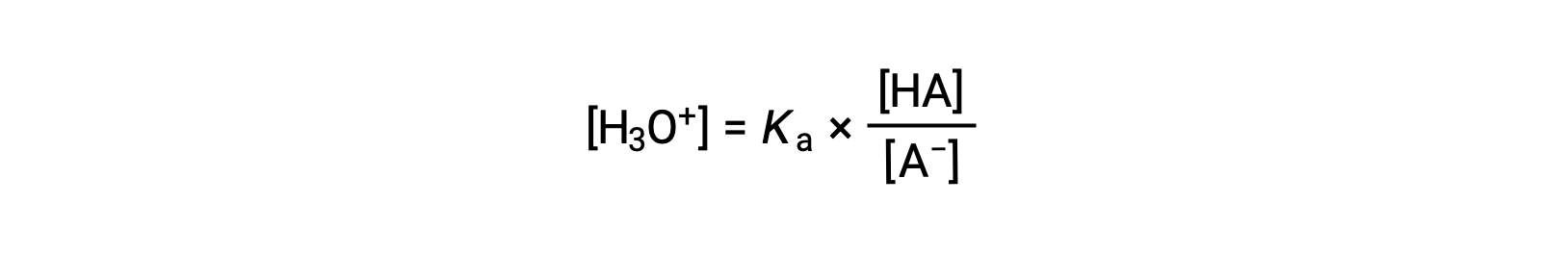
Prendre la valeur négative du logarithme des deux côtés de cette équation donne
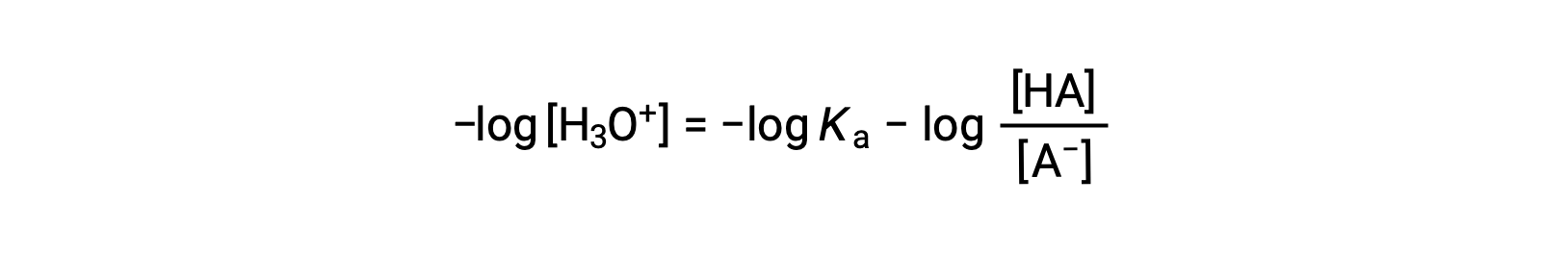
qui peut être écrit comme
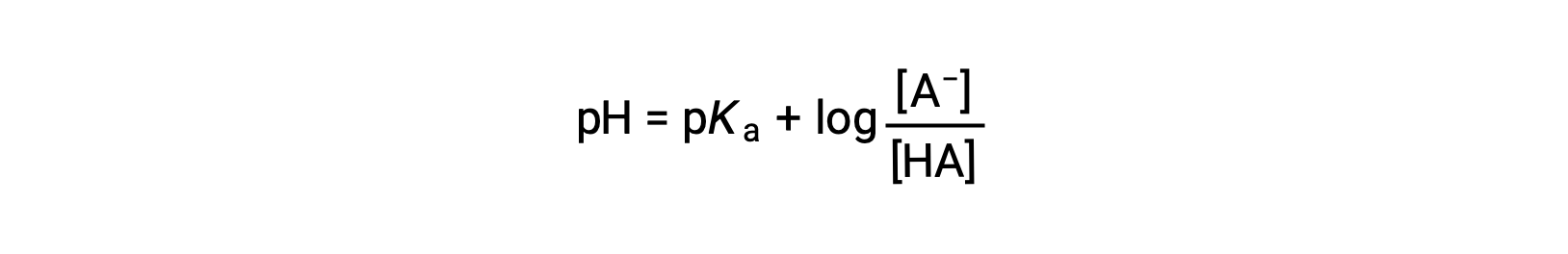
où pKa est la valeur négative du logarithme de la constante d’ionisation de l’acide faible (pKa = −log Ka). Cette équation se rapporte au pH, à la constante d’ionisation d’un acide faible et aux concentrations du couple acide-base conjugué faible dans une solution tamponnée. Les scientifiques utilisent souvent cette expression, appelée équation de Henderson-Hasselbalch, pour calculer le pH des solutions tampons. Il est important de noter que la supposition que “ x est petit ” doit être valable pour utiliser cette équation.
Lawrence Joseph Henderson et Karl Albert Hasselbalch
Lawrence Joseph Henderson (1878–1942) était un médecin, biochimiste et physiologiste américain, pour ne citer que quelques-uns de ses nombreux travaux. Il a obtenu un diplôme de médecine à Harvard et a ensuite passé 2 ans à étudier à Strasbourg, puis dans une partie de l’Allemagne, avant de revenir occuper un poste de maître de conférences à Harvard. Il est finalement devenu professeur à Harvard et y a travaillé toute sa vie. Il a découvert que l’équilibre acido-basique dans le sang humain est régulé par un système tampon formé par le dioxyde de carbone dissous dans le sang. Il a écrit une équation en 1908 pour décrire le système de tampon acide carbonique-carbonate dans le sang. Henderson était très bien informé ; en plus de ses recherches importantes sur la physiologie du sang, il a également écrit au sujet de l’adaptation des organismes et de leur adéquation avec leur environnement, de la sociologie et de l’éducation universitaire. Il a également fondé le laboratoire de la fatigue de la Harvard Business School, qui étudiait la physiologie humaine en mettant l’accent sur le travail dans l’industrie, l’exercice physique et la nutrition.
En 1916, Karl Albert Hasselbalch (1874–1962), médecin et chimiste danois, a partagé la paternité d’un article avec Christian Bohr en 1904 qui décrivait l’effet Bohr, qui montrait que la capacité de l’hémoglobine dans le sang à se lier avec l’oxygène est inversement reliée à l’acidité du sang et à la concentration de dioxyde de carbone. L’échelle de pH a été introduite en 1909 par un autre danois, Sørensen, et en 1912, Hasselbalch a publié des mesures du pH du sang. En 1916, Hasselbalch exprime l’équation de Henderson en termes logarithmiques, en accord avec l’échelle logarithmique du pH, et c’est ainsi que naît l’équation de Henderson-Hasselbalch.
Ce texte est adapté de Openstax, Chimie 2e, Section 14.6 : Tampons.
Suggested Reading
De Levie, Robert. "The Henderson-Hasselbalch equation: its history and limitations." Journal of Chemical Education 80, no. 2 (2003): 146. https://pubs.acs.org/doi/pdf/10.1021/ed080p146.
