16.3:
Ecuación de Henderson-Hasselbalch
16.3:
Ecuación de Henderson-Hasselbalch
La expresión de la constante de ionización para una solución de un ácido débil puede escribirse como:
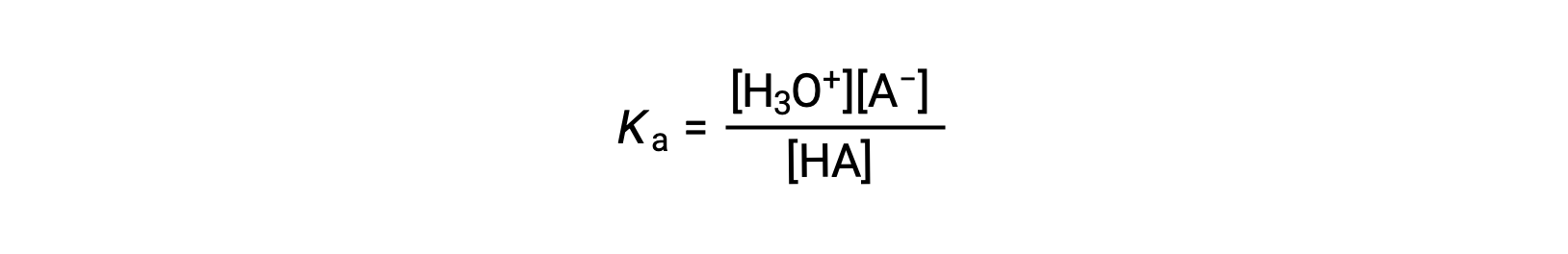
Al reorganizar para resolver [H3O+] se obtiene:
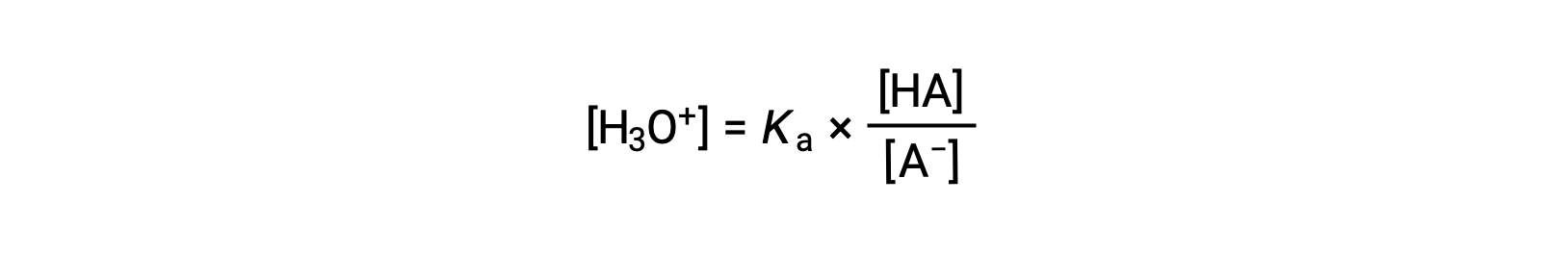
Al tomar el logaritmo negativo de ambos lados de esta ecuación queda
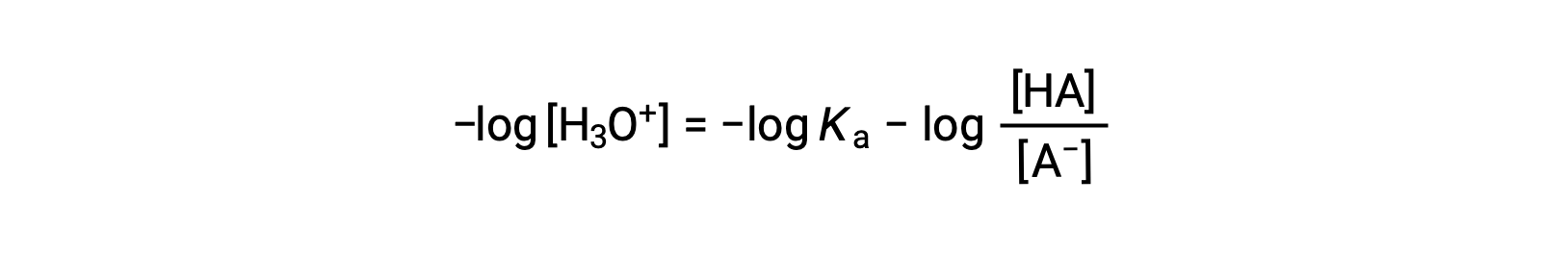
que se puede escribir como
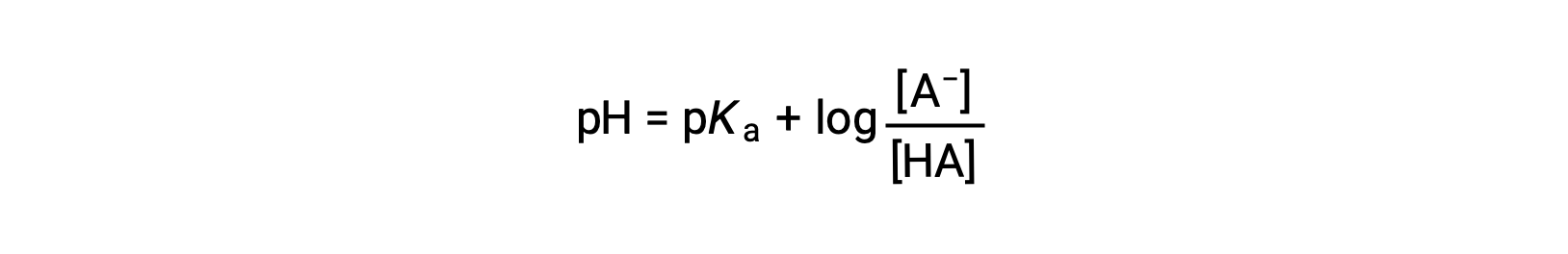
Donde pKa es el negativo del logaritmo de la constante de ionización del ácido débil (pKa = −logKa). Esta ecuación relaciona el pH, la constante de ionización de un ácido débil, y las concentraciones del par ácido-base conjugado débil en una solución tamponada. Los científicos a menudo utilizan esta expresión, llamada ecuación de Henderson-Hasselbalch, para calcular el pH de las soluciones tampón. Es importante notar que la suposición “x es pequeña” debe ser válida para usar esta ecuación.
Lawrence Joseph Henderson y Karl Albert Hasselbalch
Lawrence Joseph Henderson (1878–1942) fue un médico, bioquímico y fisiólogo estadounidense, por nombrar sólo algunas de sus muchas actividades. Obtuvo un título médico en Harvard y luego pasó 2 años estudiando en Estrasburgo, para entonces parte de Alemania, antes de regresar a tomar un puesto de instructor en Harvard. Finalmente se convirtió en profesor de Harvard y trabajó allí toda su vida. Descubrió que el equilibrio ácido-base en la sangre humana está regulado por un sistema de amortiguación formado por el dióxido de carbono disuelto en la sangre. Escribió una ecuación en 1908 para describir el sistema de tampón ácido carbónico-carbonato en sangre. Henderson tenía amplios conocimientos; además de su importante investigación sobre la fisiología de la sangre, también escribió sobre las adaptaciones de los organismos y su acoplamiento con el entorno, sobre sociología y sobre la educación universitaria. También fundó el Fatigue Laboratory en la Harvard Business School, el cual examinó la fisiología humana con un enfoque de trabajo específico en la industria, el ejercicio y la nutrición.
En 1916, Karl Albert Hasselbalch (1874–1962), un médico y químico danés, compartió la autoría en un artículo con Christian Bohr en 1904 que describía el efecto Bohr, lo que mostró que la capacidad de la hemoglobina en la sangre para unirse con el oxígeno estaba inversamente relacionada con la acidez de la sangre y la concentración de dióxido de carbono. La escala de pH fue introducida en 1909 por otro danés, Sørensen, y en 1912, Hasselbalch publicó mediciones del pH sanguíneo. En 1916, Hasselbalch expresó la ecuación de Henderson en términos logarítmicos, consistente con la escala logarítmica del pH, y así nació la ecuación de Henderson-Hasselbalch.
Este texto es adaptado de Openstax, Química 2e, Sección 14.6: Amortiguadores.
Suggested Reading
De Levie, Robert. "The Henderson-Hasselbalch equation: its history and limitations." Journal of Chemical Education 80, no. 2 (2003): 146. https://pubs.acs.org/doi/pdf/10.1021/ed080p146.
