16.3:
ヘンダーソン-ハッセルバルヒ式
16.3:
ヘンダーソン-ハッセルバルヒ式
弱酸性溶液のイオン化式は次のように書くことができます。
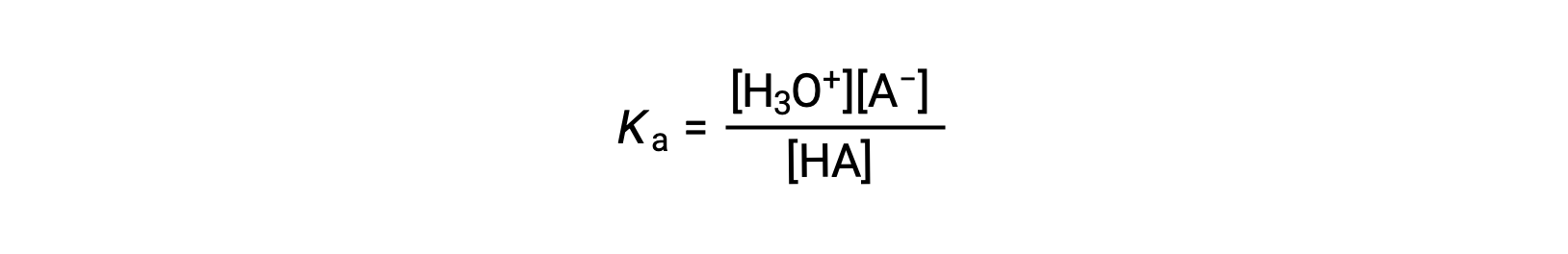
Rearranging to solve for [H3O+] yields:
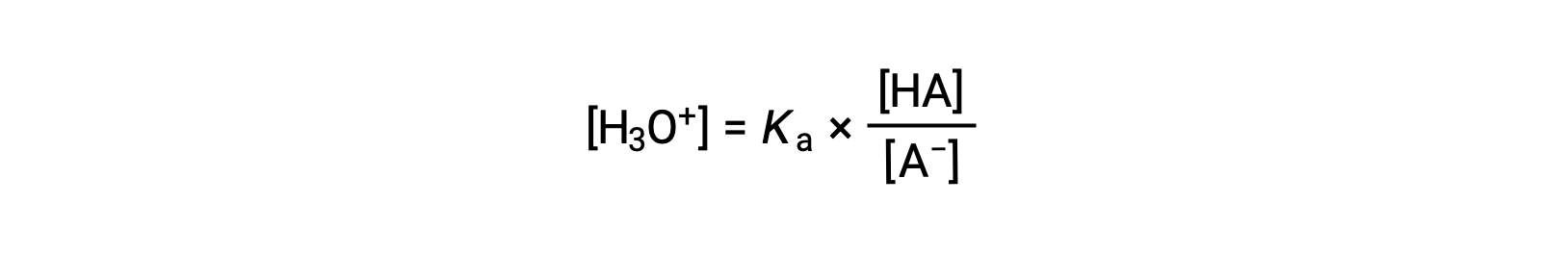
Taking the negative logarithm of both sides of this equation gives
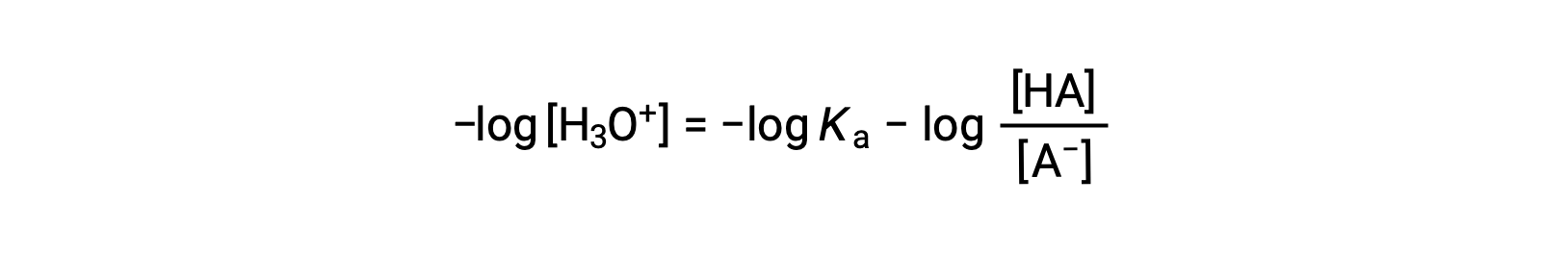
which can be written as
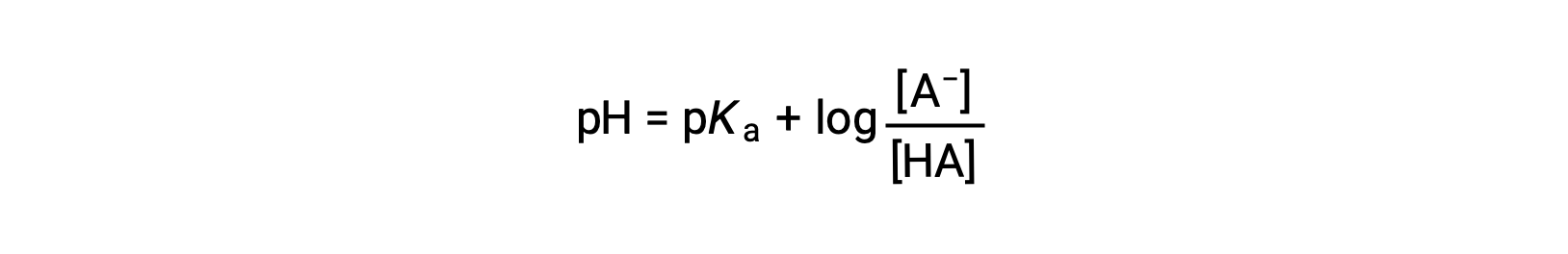
ここでpKaは弱酸における酸解離定数の対数の負の値である(pKa = −log Ka)。この式は、pH、弱酸の酸解離定数、および緩衝液中の弱共役酸・弱共役塩基対の濃度を関係づけています。科学者たちは、緩衝液のpHを計算するのに、ヘンダーソン-ハッセルバルヒ式と呼ばれるこの式をよく利用します。この式は “x が小さい”の仮定のもとで成立します。
ローレンス・ジョセフ・ヘンダーソンとカール・アルバート・ハッセルバルヒ
ローレンス・ジョセフ・ヘンダーソン(1878–1942)は、アメリカの医師、生化学者、生理学者であり、様々な分野で成果を残しました。ハーバード大学で医学の学位を取得した後、当時ドイツの一部であったストラスブールに2年間留学し、その後ハーバード大学の講師に就任しました。その後、ハーバード大学の教授となり、生涯研究を続けた。彼は、人間の血液の酸塩基平衡が、血液中に溶け込んでいる二酸化炭素によって形成される緩衝系によって調整されていることを発見しました。1908年には、血液中の炭酸-炭酸塩緩衝系を表す方程式を書いています。ヘンダーソンは幅広い知識を持っていました。血液の生理学に関する重要な研究に加えて、生物の適応や環境への適合、社会学や大学教育についても執筆しています。また、ハーバード・ビジネス・スクールに「疲労研究所」を設立し、産業界での労働、運動、栄養に焦点を当てた人間の生理学を研究していました。
1916年、デンマークの医師・化学者であるカール・アルバート・ハッセルバルヒ(1874–1962)は、1904年にクリスチャン・ボーアと共著で、血液中のヘモグロビンが酸素と結合する能力は、血液の酸性度と二酸化炭素の濃度に反比例するというBohr効果を記述した論文を発表しました。1909年には、同じくデンマーク人のセーレンセンがpHスケールを導入し、1912年にはハッセルバルヒが血液のpHの測定値を発表しました。1916年、ハッセルバルヒはヘンダーソンの式を対数で表し、pHの対数目盛と一致させ、ヘンダーソン-ハッセルバルヒ式を誕生させました。
上記の文章は以下から引用しました。 Openstax, Chemistry 2e, Section 14.6: Buffers.
Suggested Reading
De Levie, Robert. "The Henderson-Hasselbalch equation: its history and limitations." Journal of Chemical Education 80, no. 2 (2003): 146. https://pubs.acs.org/doi/pdf/10.1021/ed080p146.
