16.3:
Equazione di Henderson-Hasselbalch
16.3:
Equazione di Henderson-Hasselbalch
L’espressione costante di ionizzazione per una soluzione di un acido debole può essere scritta come:
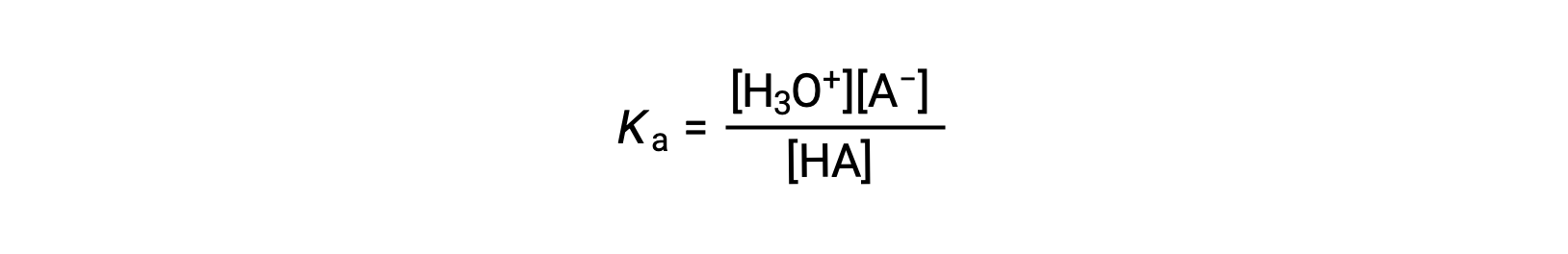
Ridisposizione per risolvere i rendimenti [H3O+]:
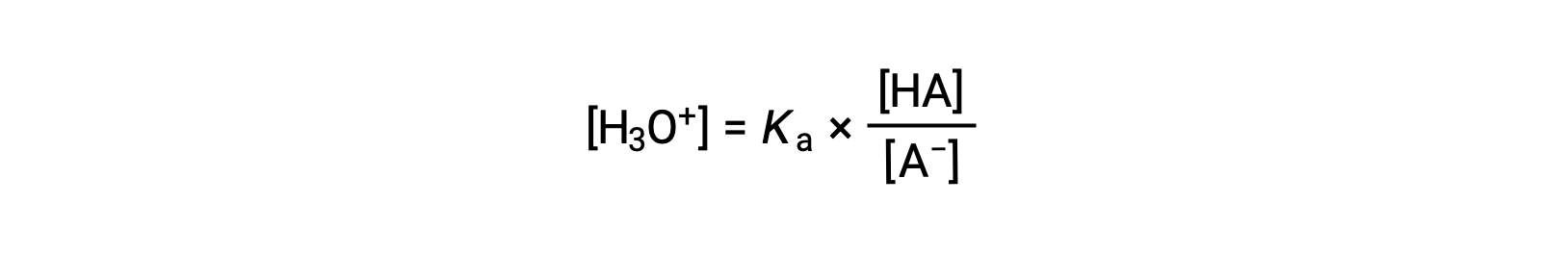
Prendendo il logaritmo negativo di entrambi i lati di questa equazione dà
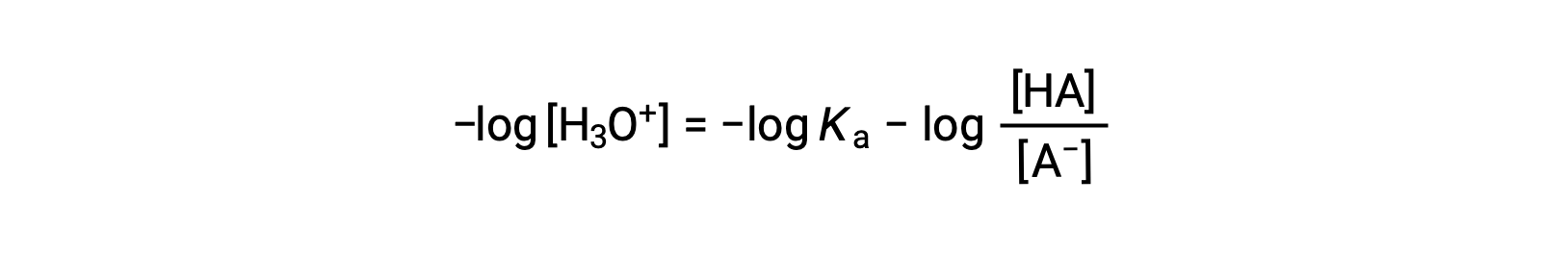
che può essere scritto come
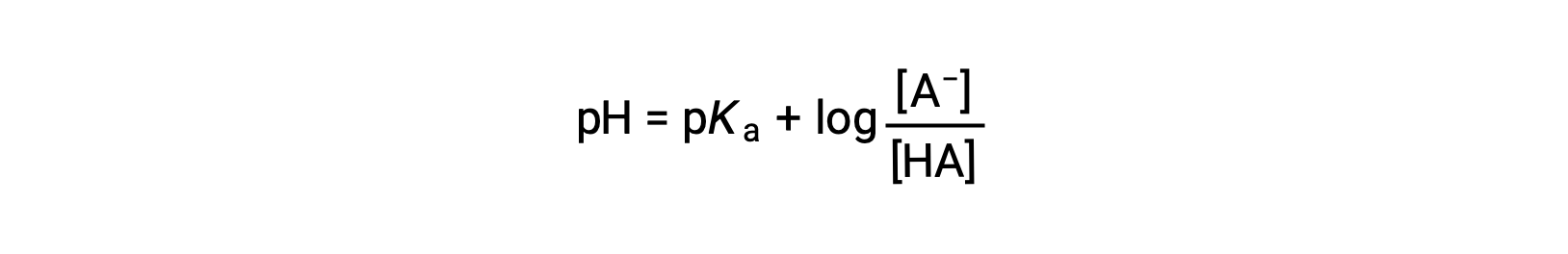
dove pKa è il negativo del logaritmo della costante di ionizzazione dell’acido debole (pKa = −log Ka). Questa equazione mette in relazione il pH, la costante di ionizzazione di un acido debole, e le concentrazioni della coppia acido-base coniugata debole in una soluzione tamponata. Gli scienziati usano spesso questa espressione, chiamata equazione di Henderson-Hasselbalch, per calcolare il pH delle soluzioni tampone. È importante notare che l’ipotesi “x è piccola” deve essere valida per usare questa equazione.
Lawrence Joseph Henderson e Karl Albert Hasselbalch
Lawrence Joseph Henderson (1878-1942) è stato un medico, biochimico e fisiologo americano, per cita solo alcune delle sue numerose attività. Ha conseguito una laurea in medicina ad Harvard e poi ha trascorso 2 anni studiando a Strasburgo, allora parte della Germania, prima di tornare a prendere una posizione di docente ad Harvard. Alla fine divenne professore ad Harvard e vi lavorò per tutta la vita. Scoprì che l’equilibrio acido-base nel sangue umano è regolato da un sistema tampone formato dall’anidride carbonica disciolta nel sangue. Scrisse un’equazione nel 1908 per descrivere il sistema tampone acido-carbonato carbonico nel sangue. Henderson era ampiamente ben informato; oltre alla sua importante ricerca sulla fisiologia del sangue, scrisse anche sugli adattamenti degli organismi e sul loro adattamento con i loro ambienti, sulla sociologia e sull’educazione universitaria. Ha anche fondato il Fatigue Laboratory presso la Harvard Business School, che ha esaminato la fisiologia umana con particolare attenzione al lavoro nell’industria, nell’esercizio fisico e nella nutrizione.
Nel 1916, Karl Albert Hasselbalch (1874-1962), un medico e chimico danese, condivise la paternità in un articolo con Christian Bohr nel 1904 che descriveva l’effetto Bohr, che mostrò che la capacità dell’emoglobina nel sangue di legarsi con l’ossigeno era inversamente correlata all’acidità del sangue e alla concentrazione di anidride carbonica. La scala del pH fu introdotta nel 1909 da un altro danese, Sørensen, e nel 1912, Hasselbalch pubblicò misurazioni del pH del sangue. Nel 1916, Hasselbalch espresse l’equazione di Henderson in termini logaritmici, coerente con la scala logaritmica del pH, e così nacque l’equazione di Henderson-Hasselbalch.
Questo testo è adattato da Openstax, Chimica 2e, Sezione 14.6: Buffers.
Suggested Reading
De Levie, Robert. "The Henderson-Hasselbalch equation: its history and limitations." Journal of Chemical Education 80, no. 2 (2003): 146. https://pubs.acs.org/doi/pdf/10.1021/ed080p146.
