16.8:
المؤشّرات
16.8:
المؤشّرات
يتغير لون بعض المواد العضوية في المحلول المخفف عندما يصل تركيز أيون الهيدرونيوم إلى قيمة معينة. على سبيل المثال ، الفينول فثالين مادة عديمة اللون في أي محلول مائي بتركيز أيون الهيدرونيوم أكبر من 5.0 × 10−9 M (pH < 8.3). في المحاليل الأكثر قاعدية حيث يكون تركيز أيون الهيدرونيوم أقل من 5.0 × 10−9 M (pH > 8.3)، أحمر أو وردي. المواد مثل الفينول فثالين، التي يمكن استخدامها لتحديد الرقم الهيدروجيني لمحلول، تسمى مؤشرات القاعدة الحمضية. مؤشرات الحمض القاعدي هي إما أحماض عضوية ضعيفة أو ضعيفة القواعد العضوية.
يمكن تمثيل التوازن في محلول مؤشر الميثيل البرتقالي الحمضي، وهو حمض ضعيف، بمعادلة نستخدم فيها HIn كتمثيل بسيط لجزيء برتقال الميثيل المعقد:
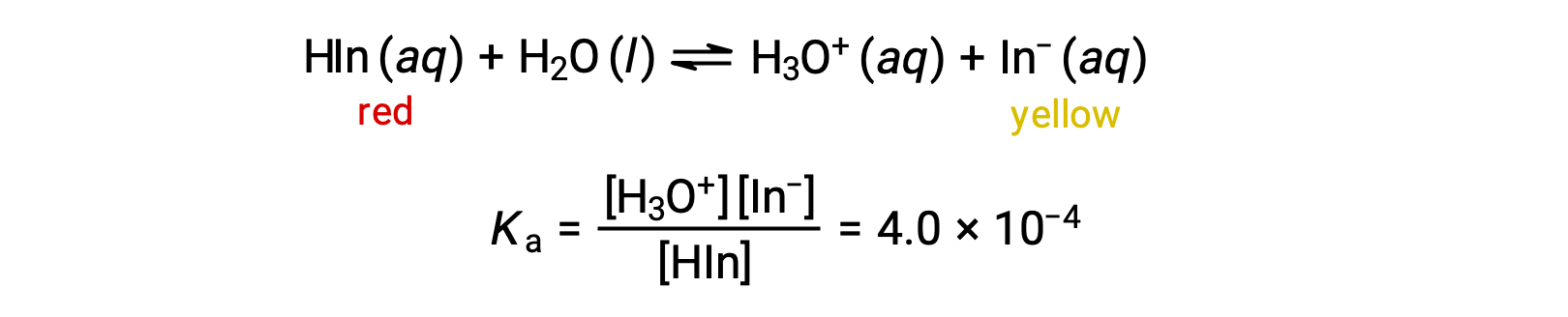
أنيون برتقال الميثيل، In−، أصفر، والصيغة غير المؤينة، HIn، باللون الأحمر. عندما نضيف حمضاً إلى محلول برتقال الميثيل، فإن زيادة تركيز أيون الهيدرونيوم ينقل التوازن نحو الشكل الأحمر غير المتأين، وفقاً لمبدأ #226;لو شاتيلير’. إذا أضفنا القاعدة، فإننا نحول التوازن نحو الشكل الأصفر. هذا السلوك مشابه تماماً لعمل المخازن المؤقتة.
يتم تحديد اللون المدرك لمحلول المؤشر من خلال نسبة تركيزات النوعين في In− و HIn. إذا كان معظم المؤشر (عادةً حوالي 60−90% أو أكثر) موجودًا على النحو التالي في In−، يكون اللون المدرك للحل أصفر. إذا كان معظمها موجوداً على شكل HIn، فسيظهر لون المحلول باللون الأحمر. تُعد معادلة هندرسون-هانسنبلاخ مفيدة لفهم العلاقة بين الرقم الهيدروجيني لحل المؤشر وتكوينه (وبالتالي، اللون المدرك):
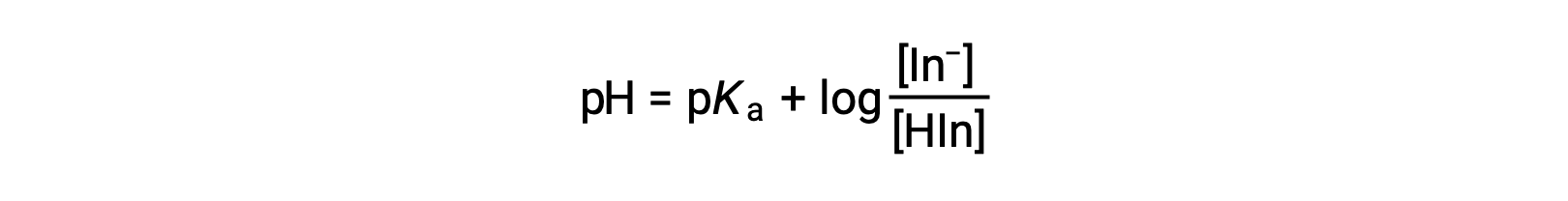
في المحاليل حيث الرقم الهيدروجيني > pKa، يجب أن يكون المصطلح اللوغاريتمي موجباً، مما يشير إلى زيادة شكل القاعدة المترافق للمؤشر (الحل الأصفر). عندما يكون الرقم الهيدروجيني > pKa، يجب أن يكون مصطلح السجل سالباً، مما يشير إلى وجود فائض من الحمض المترافق (محلول أحمر). عندما يكون الرقم الهيدروجيني للحل قريبًا من المؤشر pKa، توجد كميات ملحوظة من كلا الزوجين المقترنين ، ويكون لون المحلول هو مزيج مضاف من كل منهما (أصفر) والأحمر، ينتج عنها البرتقالي). يتم تعريف الفاصل الزمني لتغيير اللون (أو فاصل الأس الهيدروجيني) لمؤشر القاعدة الحمضية على أنه نطاق قيم الأس الهيدروجيني التي يتم خلالها ملاحظة تغير في اللون، وبالنسبة لمعظم المؤشرات، يكون هذا النطاق تقريبًاpKa ± 1.
هناك العديد من مؤشرات القاعدة الحمضية المختلفة التي تغطي نطاقاً واسعاً من قيم الأس الهيدروجيني ويمكن استخدامها لتحديد الرقم الهيدروجيني التقريبي لمحلول غير معروف من خلال عملية الإزالة. تحتوي المؤشرات العالمية وورق الأس الهيدروجيني على مزيج من المؤشرات وتعرض ألوانًا مختلفة عند درجات حموضة مختلفة.
هذا النص مقتبس من Openstax, Chemistry 2e, Section 14.7: Acid-Base Titrations.
Suggested Reading
Coleman, William F. "Molecular models of indicators." Journal of Chemical Education 87 no.1, (2008):1152 https://pubs.acs.org/doi/pdf/10.1021/ed800038w.
