16.8:
Индикаторы
16.8:
Индикаторы
Некоторые органические вещества меняют цвет в разбавленном растворе раствор, когда концентрация ионов гидрония достигает определенного значения. Например, фенилфталеин является бесцветным веществом в любой водной раствор с концентрацией ионов гидрония выше 5.0 × 10-9 M (pH < 8.3). В более простых растворах, где концентрация ионов гидрония меньше 5.0 × 10-9 M (pH > 8.3), он красный или розовый. Такие вещества, как фенолфталеин, которые могут использоваться для определения pH раствор, называются индикаторами кислотно-основная. Индикаторы кислотно-основная являются либо слабыми органическими кислотами, либо слабыми органическими основаниями.
Равновесие в раствор индикатора кислотно-основная метилового апельсина, слабой кислоты, может быть представлено уравнением, в котором мы используем Hin как простое представление для сложной молекулы метилового апельсина:
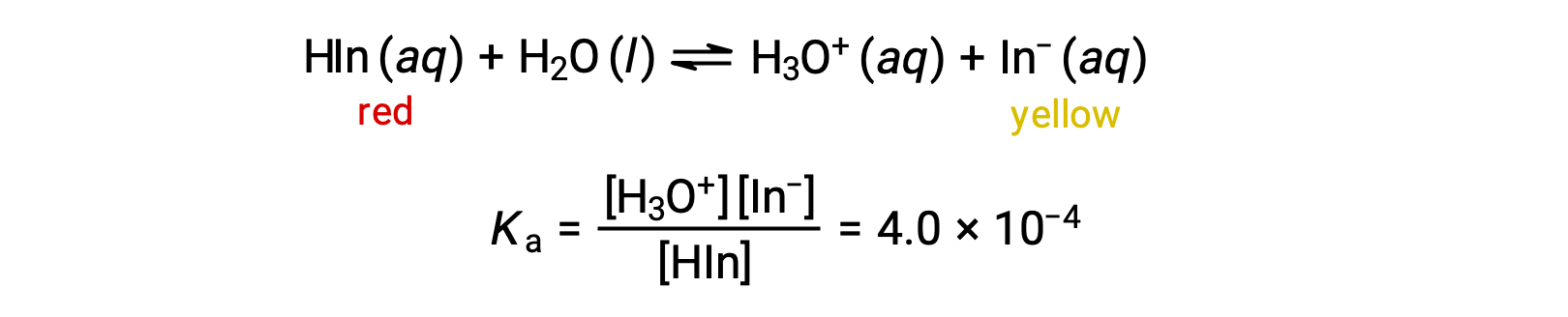
Анион метилового апельсина желтого цвета, а неионизированная форма, Hin, красного цвета. Когда мы добавляем кислоту в раствор метилового апельсина, повышенная концентрация ионов гидрония смещает равновесие в сторону неионизированной красной формы в соответствии с принципом Ле Шатье. Если мы добавим основание, мы смеем равновесие в сторону желтой формы. Это поведение полностью аналогично действию буферов.
Воспринимаемый цвет индикатора раствор определяется соотношением концентраций двух видов в и Хин. Если большая часть индикатора (обычно около 60-90% или более) присутствует как in-, воспринимаемый цвет раствор является желтым. Если большая часть присутствует как Hin, то цвет раствор будет красным. Уравнение Хендерсона-Хасселбалха полезно для понимания связи между рН индикатора раствор и его составом (таким образом, воспринимаемый цвет):
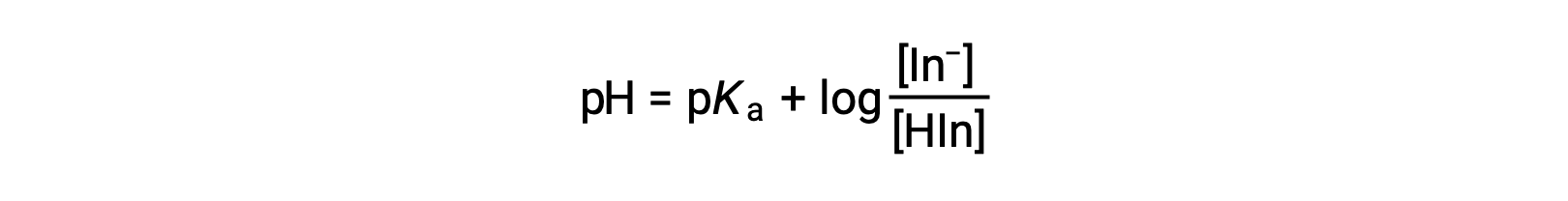
В растворах, где pH > pKa, логарифмический термин должен быть положительным, указывая на превышение конъюгатной формы основание индикатора (желтый раствор). Когда pH > pKa, срок логарифмики должен быть отрицательным, что указывает на избыток конъюгатной кислоты (Red раствор). Когда показатель pH раствор близок к индикатору pKa, присутствуют значительные количества обоих сопряженных партнеров, а цвет раствор является добавкой комбинации каждого из них (желтый и красный, дающий оранжевый цвет). Интервал смены цвета (или интервал pH) для индикатора кислотно-основная определяется как диапазон значений pH, в течение которого наблюдается изменение цвета, и для большинства индикаторов этот диапазон составляет приблизительно pKa ± 1.
Существует множество различных индикаторов кислотно-основная, которые охватывают широкий диапазон значений pH и могут быть использованы для определения приблизительного pH неизвестного раствор путем устранения. Универсальные индикаторы и бумага pH содержат смесь индикаторов и имеют разные цвета при разных PH.
Этот текст адаптирован из Openstax, Химия 2е изд., раздел 14.7: Титраки кислотно-основная.
Suggested Reading
Coleman, William F. "Molecular models of indicators." Journal of Chemical Education 87 no.1, (2008):1152 https://pubs.acs.org/doi/pdf/10.1021/ed800038w.
