16.9:
다양성자 산의 적정
A subscription to JoVE is required to view this content. Sign in or start your free trial.
JoVE Core
Chemistry
Titration of a Polyprotic Acid
다양성자산은 다중 이온화 양성자를 포함하고 있으며 이 양성자 각각은 별개의 단계로 분리됩니다. 각각의 양성자의 손실에 따라 Ka가 서로 다르며 각각의 후속 산해리 상수는 이전의 것보다 약합니다. 예를 들어 아황산에는 두 개의 이온화 양성자가 있습니다.첫 번째 양성자 해리의 Ka1은 1.6 10⁻²이고 두 번째 양성자 해리의 Ka2는 6.4 10⁻⁸입니다. 만약 아황산이 수산화 나트륨과 같은 강염기로 적정화되면 첫 번째 이온화 양성자는 처음에 제거되어 아황산 수소염 이온을 생성하게 됩니다. 이 적정 곡선 부분은 일양성자 산과 강염기의 곡선과 비슷합니다.곡선에는 당량점이 있으며 반 당량점에서의 솔루션의 pH는 pKa1과 같습니다. 더 많은 염기가 추가되면서 두 번째 이온화 양성자가 중화됩니다. 아황산 수소염 이온의 농도는 초기 아황산과 같기 때문에 이를 중화시키기 위해서는 동일한 양의 염기가 필요합니다.따라서 이염기산 한 몰을 완전히 중화시키기 위해서는 두 몰의 염기가 필요합니다. 두 번째 중화 단계의 적정 곡선에는 용액의 pH가 pKa2와 같은 첫 번째 반 당량점과 염기 영역에 있는 두 번째 당량점도 있습니다. 마찬가지로 강염기를 가진 삼양성자 인산의 적정화 곡선은 세 개의 당량점을 갖습니다.따라서 약한 다양성자 산을 적정하는 동안 이온화 양성자의 Ka 값 사이의 차이가 10, 000배 이상인 한 적정 곡선에서 생성된 당량점의 수는 존재하는 이온화 양성자의 수와 같습니다.
16.9:
다양성자 산의 적정
폴리프로틱산은 두 개 이상의 이온화 수소를 함유하고 있으며 단계별 이온화 과정을 거칩니다. 이온화 양성자의 산 해리 상수가 서로 충분히 다른 경우, 이러한 폴리프로틱산에 대한 적정 곡선은 각 이온화수소에 대해 뚜렷한 동등점을 생성합니다. 따라서, 이보성의 적정은 2개의 등가점의 형성을 초래하는 반면, 삼중산의 적정은 적정 곡선에 3개의 등가점의 형성을 초래한다.
탄산, H2CO3은,약한 이프로틱산의 예입니다. 탄산산의 첫 번째 이온화는 소량으로 이온과 중탄산염 이온을 산출한다.
첫 번째 이온화:
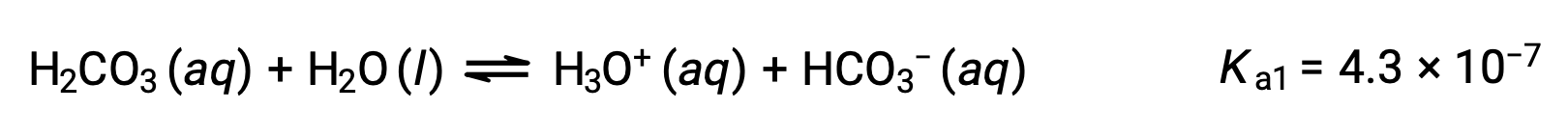
중탄산염 이온은 또한 산역할을 할 수 있습니다. 그것은 이온화하고 더 적은 양으로 하이드로늄 이온과 탄산이온을 형성한다.
두 번째 이온화:
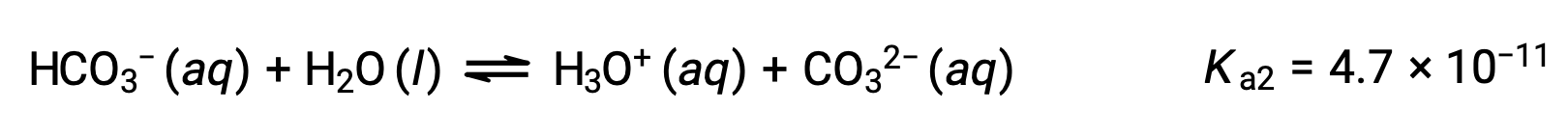
Ka1은 K a2보다 104배더 큽습니다. 따라서H2CO3이 NaOH와 같은 강한 염기와 함께 성화되면 각 이온화 수소에 대해 두 개의 고유 동등점을 생성합니다.
삼중산인 인산은 세 단계로 이온화됩니다.
첫 번째 이온화:
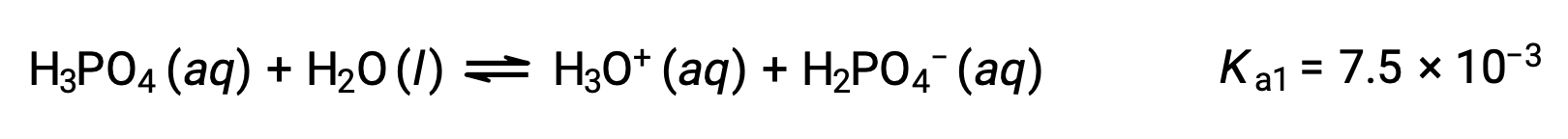
두 번째 이온화:
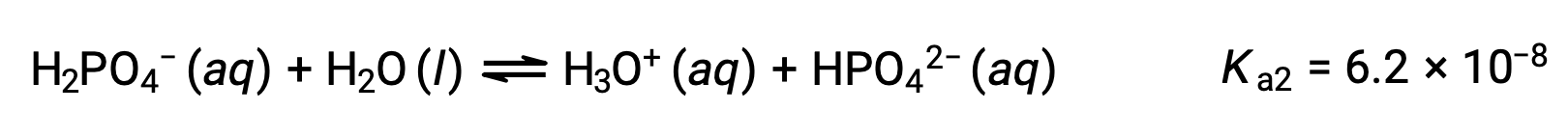
세 번째 이온화:
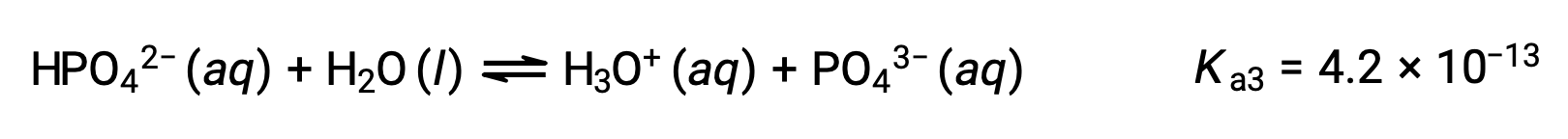
H3PO4가 KOH와 같은 강력한 베이스로 화티로 화하면 이온화 수소마다 3개의 동등점을 생성합니다. 그러나, HPO42−는 매우 약한 산이기 때문에, 세 번째 동등점은 적정 곡선에서 쉽게 식별할 수 없습니다.
