16.9:
Титрование полипротонной кислоты
16.9:
Титрование полипротонной кислоты
Полипростическая кислота содержит более одного ионизируемых водорода и проходит поэтапный процесс ионизации. Если константы диссоциации кислотной кислоты ионируемых протонов отличаются друг от друга в достаточной степени, то кривая титрования для такой полипроптической кислоты создает различную точку эквивалентности для каждого из ее ионируемых гидгенов. Поэтому титрование дипротической кислоты приводит к образованию двух точек эквивалентности, в то время как титрование трипротической кислоты приводит к образованию трех точек эквивалентности на кривой титрования.
Карбоновая кислота, H2CO3, является примером слабой диметической кислоты. Первая ионизация карбоновой кислоты приводит к образованию ионов гидрония и ионов бикарбоната в небольших количествах.
Первая ионизация:
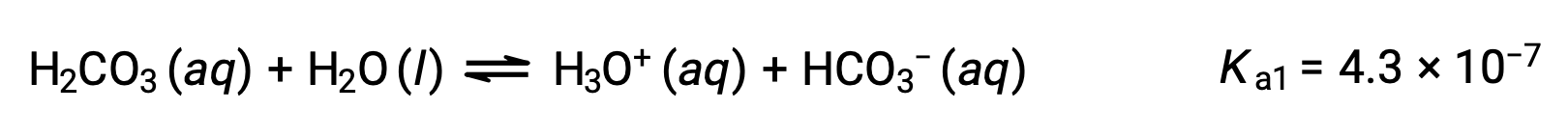
Бикарбонат-ион также может выступать в качестве кислоты. Он ионизирует и образует ионы гидрония и карбонатные ионы в еще меньших количествах.
Вторая ионизация:
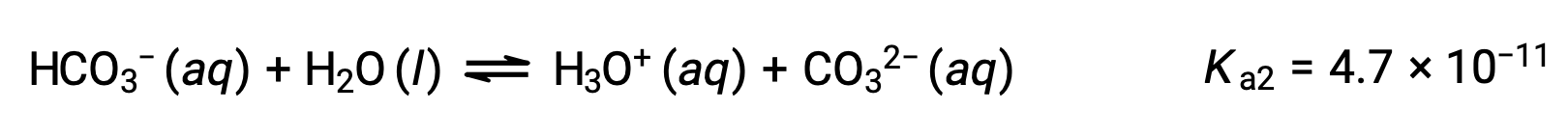
KA1 больше KA2 в 104 раз. Поэтому, когда H2CO3 титруется с сильным основание, как NaOH, он производит два отдельных точки эквивалентности для каждого ионизированного водорода.
Фосфорная кислота, трипростическая кислота, ионизируется в три этапа:
Первая ионизация:
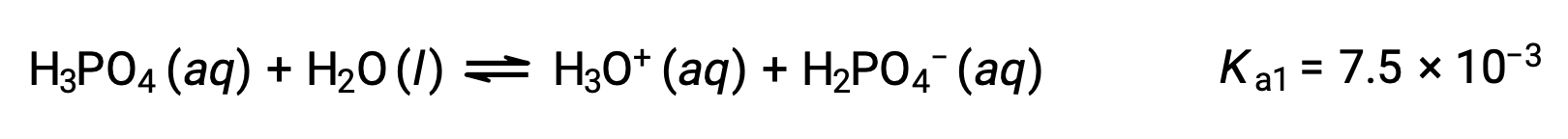
Вторая ионизация:
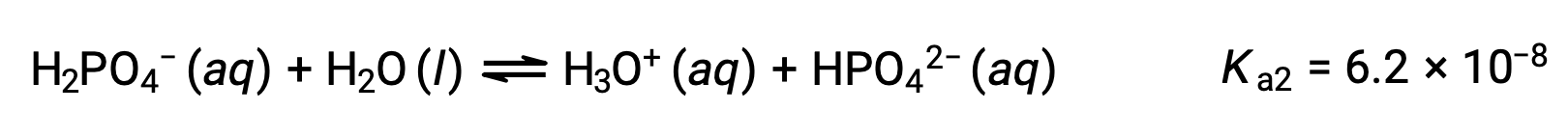
Третья ионизация:
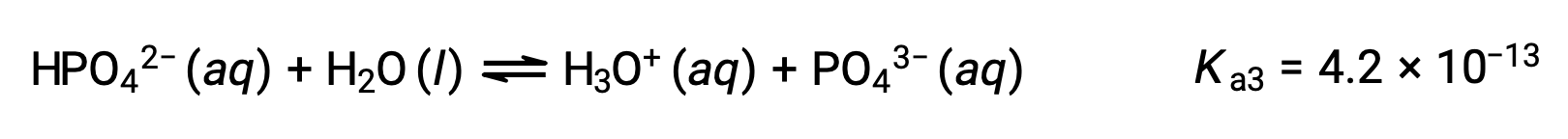
Когда H3PO4 титруется сильным основание как KOH, он производит три точки эквивалентности для каждого ионизированного водорода. Однако, поскольку HPO42 является очень слабой кислотой, третья точка эквивалентности не легко различима на кривой титрования.
Этот текст адаптирован из Openstax, Химия 2е изд., раздел 14.5: Полибростические кислоты.
