16.10: Titulação de um Ácido Poliprótico
Um ácido poliprótico contém mais de um hidrogénio ionizável e sofre um processo de ionização por passos. Se as constantes de dissociação ácida dos protões ionizáveis diferirem suficientemente umas das outras, então a curva de titulação para esse ácido poliprótico gera um ponto de equivalência distinto para cada um dos seus hidrogénios ionizáveis. Por conseguinte, a titulação de um ácido diprótico resulta na formação de dois pontos de equivalência, enquanto que a titulação de um ácido triprótico resulta na formação de três pontos de equivalência na curva de titulação.
O ácido carbónico, H2CO3, é um exemplo de um ácido diprótico fraco. A primeira ionização do ácido carbónico produz iões hidrónio e iões bicarbonato em pequenas quantidades.
Primeira ionização:
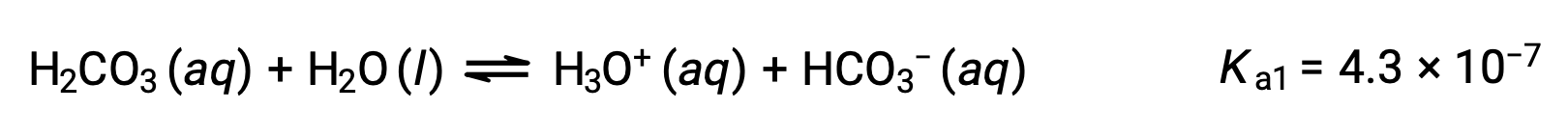
O ião bicarbonato também pode funcionar como um ácido. Ioniza e forma iões hidrónio e iões carbonato em quantidades ainda mais pequenas.
Segunda ionização:
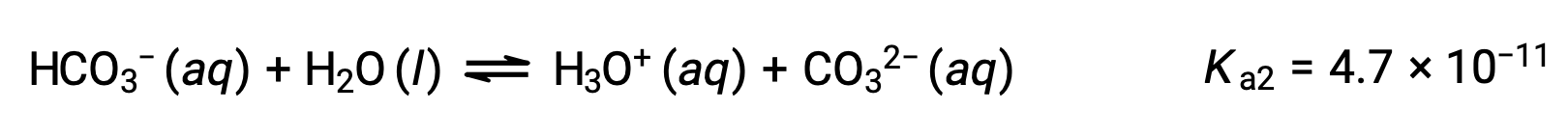
Ka1 é maior que Ka2 por um factor de 104. Portanto, quando H2CO3 é titulado com uma base forte como NaOH, produz dois pontos de equivalência distintos para cada hidrogénio ionizável.
O ácido fosfórico, um ácido triprótico, ioniza em três passos:
Primeira ionização:
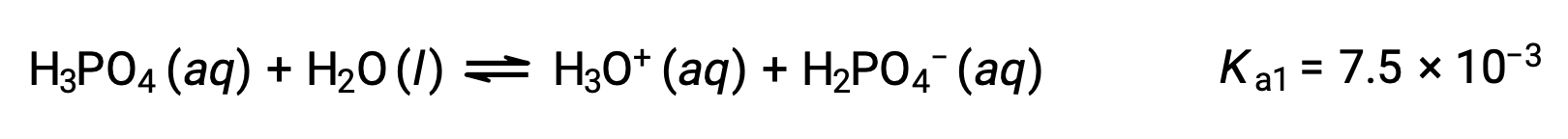
Segunda ionização:
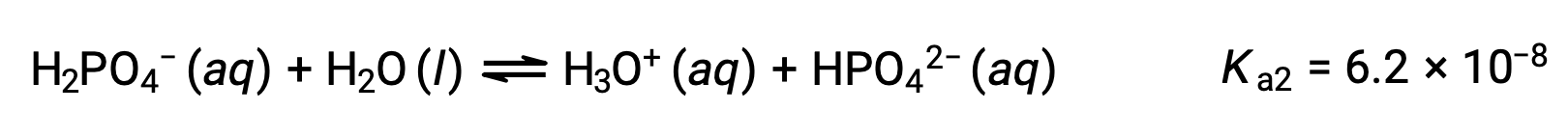
Terceira ionização:
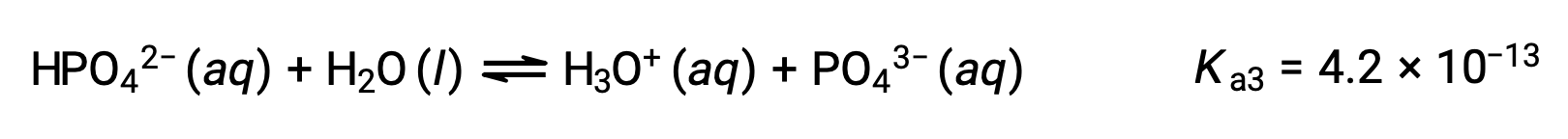
Quando H3PO4 é titulado com uma base forte como KOH, produz três pontos de equivalência para cada hidrogénio ionizável. No entanto, uma vez que HPO42− é um ácido muito fraco, o terceiro ponto de equivalência não é facilmente perceptível na curva de titulação.
Este texto é adaptado de Openstax, Chemistry 2e, Section 14.5: Polyprotic Acids.


