16.10: Titrage d'un polyacide
Un acide polyprotique contient plus d'un hydrogène ionisable et subit un processus d'ionisation par étapes. Si les constantes de dissociation acide des protons ionisables diffèrent suffisamment l'une de l'autre, la courbe de titrage de ces acides polyprotiques génère un point d'équivalence distinct pour chacun de ses hydrogènes ionisables. Par conséquent, le titrage d'un acide diprotique entraîne la formation de deux points d'équivalence, alors que le titrage d'un acide triprotique conduit à la formation de trois points d'équivalence sur la courbe de titrage.
L'acide carbonique, H2CO3, est un exemple d'acide diprotique faible. La première ionisation de l'acide carbonique produit des ions hydronium et des ions bicarbonate en petites quantités.
Première ionisation :
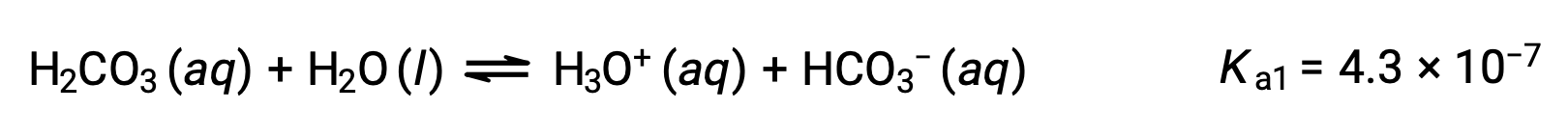
L'ion bicarbonate peut également agir comme un acide. Il s'ionise et forme des ions hydronium et des ions carbonate en quantités encore plus petites.
Seconde ionisation :
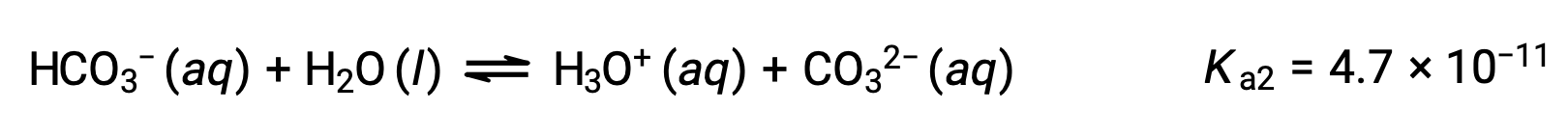
Le Ka1 est plus grand que le Ka2 par un facteur de 104. Par conséquent, lorsque H2CO3 est titré avec une base forte comme NaOH, il produit deux points d'équivalence distincts pour chaque hydrogène ionisable.
L'acide phosphorique, un acide triprotique, s'ionise en trois étapes :
Première ionisation :
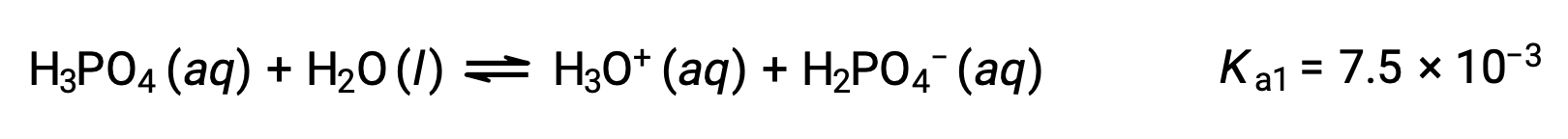
Deuxième ionisation :
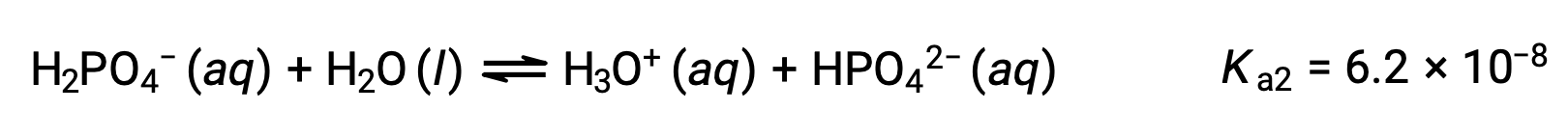
Troisième ionisation :
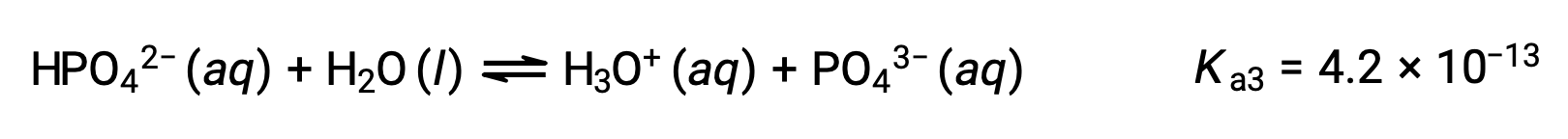
Lorsque H3PO4 est titré avec une base forte comme KOH, il produit trois points d'équivalence pour chaque hydrogène ionisable. Cependant, comme HPO42− est un acide très faible, le troisième point d'équivalence n'est pas facilement discernable sur la courbe de titrage.
Ce texte est adapté de Openstax, Chimie 2e, Section 14.5 : Acides polyprotiques.


