16.10:
توازنات الذوبان
16.10:
توازنات الذوبان
يتم إنشاء توازن الذوبان عندما يحدث انحلال وترسيب الأنواع المذابة بمعدلات متساوية. تكمن هذه التوازن في العديد من العمليات الطبيعية والتكنولوجية، بدءاً من تسوس الأسنان إلى تنقية المياه. وبالتالي، فإن فهم العوامل التي تؤثر على قابلية الذوبان المركب ، ضروري للإدارة الفعالة لهذه العمليات. يطبق هذا القسم مفاهيم وأدوات التوازن التي تم تقديمها سابقاً على الأنظمة التي تتضمن الذوبان والترسيب.
منتج الذوبان
تذكر أن قابلية ذوبان المادة يمكن أن تختلف من صفر أساساً (غير قابل للذوبان أو قليل الذوبان) إلى ما لا نهاية (الامتزاج). يمكن أن ينتج المذاب ذو الذوبان المحدود محلول مشبع عند إضافته إلى مذيب بكمية تزيد عن قابليته للذوبان، مما ينتج عنه خليط غير متجانس من المحلول المشبع والكمّية الزائدة غير المذابة من المذاب. على سبيل المثال، المحلول المشبع من كلوريد الفضة هو المحلول الذي تم فيه تحقيق التوازن الموضح أدناه.
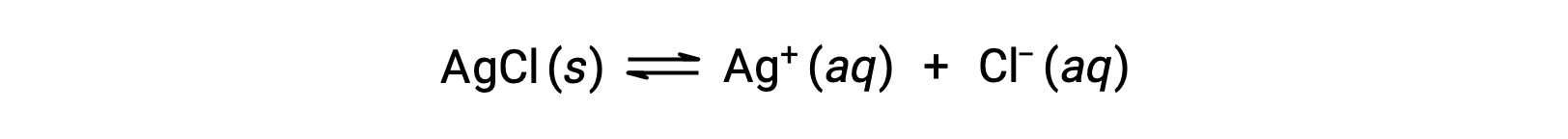
في هذا المحلول، يذوب الفائض من AgCl الصلب ويتفكك لإنتاج أيونات مائية Ag+ و Cl– بنفس المعدل الذي تتحد فيه هذه الأيونات المائية وترسب لتشكيل AgCl الصلبة. نظرًا لأن كلوريد الفضة هو ملح قليل الذوبان، فإن تركيز الأيونات الذائبة في المحلول يكون منخفضًا نسبيًا.
يسمى ثابت التوازن لتوازن الذوبان مثل هذا ثابت منتج الذوبان ، Ksp، في هذه الحالة
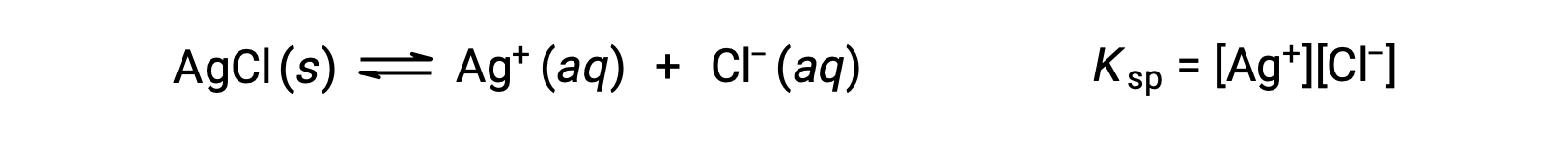
تذكر أنه يتم تمثيل الغازات والمذابات فقط في التعبيرات الثابتة للتوازن، لذلك لا يتضمن Ksp مصطلحًا لـ AgCl غير المحلول.
< Ksp والذوبان
قد يرتبط Ksp لمركب أيوني قليل الذوبان ببساطة بقابلية الذوبان المقاسة بشرط أن تتضمن عملية الذوبان فقط التفكك والذوبان ، على سبيل المثال:
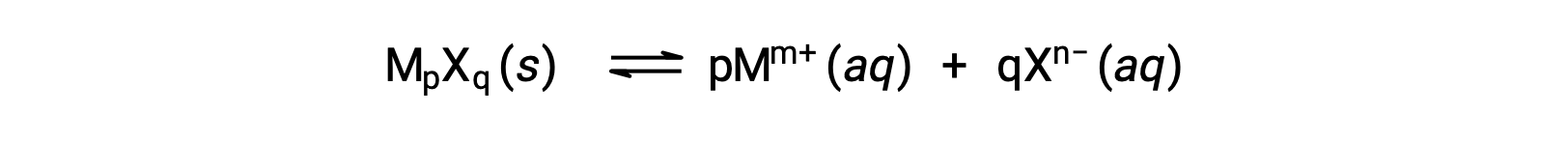
في مثل هذه الحالات، قد يشتق المرء قيم Ksp من قابلية الذوبان المتوفرة، أو العكس. يتم إجراء الحسابات من هذا النوع بشكل أكثر ملاءمة باستخدام قابلية الذوبان المولارية للمركب’، والتي يتم قياسها على أنها مولات المذاب المنحلّة لكل لتر من المحلول المشبع.
توقع هطول الأمطار
المعادلة التي تصف التوازن بين كربونات الكالسيوم الصلبة وأيوناتها المنحلة هي:
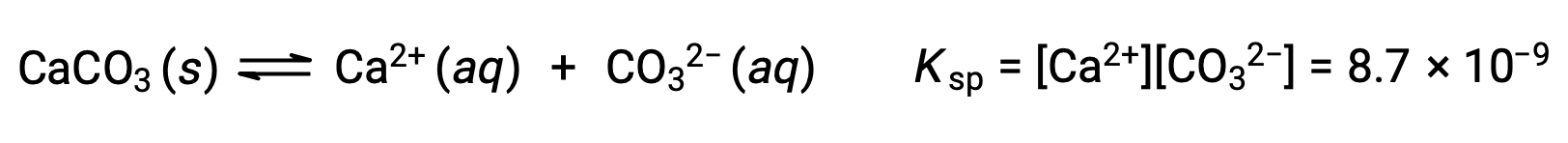
من المهم أن ندرك أن هذا التوازن يتم إنشاؤه في أي محلول مائي يحتوي على أيونات Ca2+ و CO32–، ليس فقط في محلول يتكون من تشبع الماء بكربونات الكالسيوم. ضع في اعتبارك، على سبيل المثال، خلط المحاليل المائية للمركبات القابلة للذوبان كربونات الصوديوم ونترات الكالسيوم. إذا كانت تركيزات أيونات الكالسيوم والكربونات في الخليط لا تنتج حاصل تفاعل، Q، الذي يتجاوز منتج الذوبان، Ksp، فإنه لن يحدث ترسيب. إذا أسفرت تركيزات الأيونات عن ناتج تفاعل أكبر من منتج قابلية الذوبان، فسيحدث الترسيب، مما يؤدي إلى خفض تلك التركيزات حتى يتحقق التوازن (Q = Ksp). تعد مقارنة Q بـ Ksp للتنبؤ بالترسيب مثالاً على النهج العام لتوقع اتجاه التفاعل الذي تم تقديمه لأول مرة في الدروس على التوازن. بالنسبة للحالة المحددة لتوازن الذوبان:
س & # 60 ؛ K sp : يستمر التفاعل في الاتجاه الأمامي (المحلول ليس مشبعًا ، ولم يلاحظ هطول)
Q < Ksp: يستمر التفاعل في الاتجاه العكسي (المحلول مفرط التشبع؛ سيحدث الترسيب)
هذا النص مقتبس من Openstax, Chemistry 2e, Section 15.1: Precipitation and Dissolution.
Suggested Reading
- Clifford, A. F. "The Prediction of Solubility Product Constants1." Journal of the American Chemical Society 79, no. 20 (1957): 5404-5407.
- Hill, Arthur E. "The Inconstancy Of The Solubility Product." Journal of the American Chemical Society 32, no. 10 (1910): 1186-1193.
- Reynolds, John P. "Ksp experiment: The solubility product for barium hydroxide." Journal of Chemical Education 52, no. 8 (1975): 521.
